研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁
已知:

则CO 还原Fe2O3(s)的热化学方程式为 。
(2)尾气中的CO 主要来自于汽油不完全燃烧。有人设想按下列反应除去CO:
 ,简述该设想能否实现的依据: 。
,简述该设想能否实现的依据: 。
(3)CO2 和H2充入一定体积的密闭容器中,在两种温度下发生反应:
测得CH3OH 的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,此反应在恒.压.容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2 个C=O 断裂的同时有6 个H-H 断裂

(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2。在0~15 小时内,CH4的平均生成速率I、II 和III 从小到大的顺序为 (填序号)。
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图3:
①当温度在 范围时,温度是乙酸生成速率的主要影响因素。
②Cu2Al2O4难溶于水,可溶于浓硝酸并放出红棕色气体,写出反应的离子方程 。
有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如下图所示。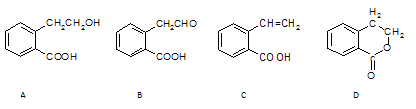
(1)B中的含氧官能团名称是。
(2) A→C的反应类型是 ;A~D中互为同分异构体的是。
;A~D中互为同分异构体的是。
(3)由A生成B的化学方程式是。
(4)C在一定条件下发生加聚反应的化学方程式是。
向含有Cl-、Br-、I-、Fe2+的溶液中,加入足量的溴水,反应后溶液中离子数量明显减少的是;离子数量基本不变的是。
工业上制造普通玻璃的主要原料是 、 、____,普通玻璃的成份是 。工业上制水泥则以、为主要原料。
请写出下列反应的离子方程式:
①氯气与氯化亚铁溶液的反应____________________________
②二氧化锰与浓盐酸反应_______________________________________
③氢氧化铝与足量氢氧化钠反应________
④ 偏铝酸钠与过量二氧化碳的反应_____
镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填化学式);
(2)将生成的产物加入水中,其中一种产物可与水生成难溶于水的白色沉淀和能使红色石蕊试纸变蓝的气体,请写出该反应方程式。