下列反应的离子方程式错误的是
| A.向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合 Ba2++OH-+HCO3-=BaCO3↓+H2O |
| C.氯化铝与过量氨水反应 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.过量CO2通入氢氧化钡的稀溶液中 CO2+OH-=HCO3- |
化学与生活密切相关,下列说法不正确的是
| A.二氧化硫可广泛用于食品的增白 | B.葡萄糖可用于补钙药物的合成 |
| C.聚乙烯塑料制品可用于食品的包装 | D.次氯酸钠溶液可用于环境的消毒杀菌 |
下列图示与对应的叙述相符的是
A.由图甲可以判断:对于反应aA(g)+bB(g) cC(g),若T1>T2,则a +b=c且 △H<0 cC(g),若T1>T2,则a +b=c且 △H<0 |
B.图乙表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L醋酸溶液得到的滴定曲线 |
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-= H2↑+2OH- |
常温下,下列表述正确的是
| A.pH=3的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 |
| B.向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 |
| C.将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)=c(HCO3-)>c(H+) |
下列实验操作、现象和结论均正确的是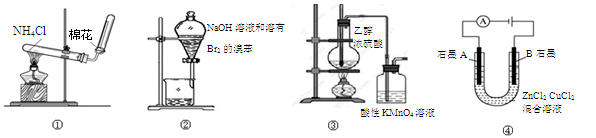
| 选项 |
操作 |
现象 |
结论 |
| A |
①将湿润的红色石蕊试纸靠近试管口 |
试纸不变色 |
NH4Cl受热不分解 |
| B |
②中振荡后静置 |
下层液体颜色变浅 |
NaOH溶液可除去溶在溴苯中的Br2 |
| C |
③加热 |
洗气瓶中溶液褪色 |
生成了乙烯 |
| D |
④通电 |
A极上有红色固体析出 |
不能说明锌的金属性比铜强 |