乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是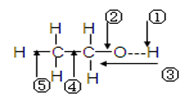
| A.和金属钠作用时,键②断裂 |
| B.和浓硫酸共热至170℃时,键①和⑤断裂 |
| C.和乙酸、浓硫酸共热时,键①断裂 |
| D.在铜催化下和氧气反应时,键①和②断裂 |
下列有关铝及铝合金说法错误的是
| A.氧化铝是一种高硬度、高熔沸点的化合物 |
| B.铝是活泼的金属,其合金抗腐蚀能力差 |
| C.铝合金具有密度小、高强度及较好的可塑性 |
| D.铝合金可用于制飞机骨架等 |
配制250mL 0.5moL/L的NaOH溶液,在下列仪器中:①量筒②250mL容量瓶③托盘天平和砝码④500mL容量瓶⑤烧杯⑥玻璃棒⑦漏斗⑧药匙⑨胶头滴管⑩250mL的烧瓶,需要用到的仪器按先后顺序排列正确的是
| A.⑧③⑤⑥②⑨ | B.②③⑦⑤⑥ | C.②⑤⑦⑥① | D.④③⑦⑤⑥ |
下列实验操作中,正确的是
| A.用托盘天平称量药品时,左盘放药品,右盘放砝码 |
| B.向试管中滴加试剂时,将滴管下端紧靠试管内壁 |
| C.烧瓶和烧杯在酒精灯上直接加热 |
| D.使用试纸检验溶液的性质时,将试纸浸入溶液中 |
将金属钠分别投入下列物质的水溶液中,既有气体生成又有蓝色沉淀生成的是
| A.HCl | B.K2SO4 | C.CuCl2 | D.Ca(HCO3)2 |
钠与水反应时产生的各种现象如下:
①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消
失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中正确的一组是
| A.①②③④⑤ | B.全部 | C.①③④⑤⑥ | D.①③④⑥ |