300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=________已知K300℃<K350℃,则ΔH_______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为___________,D的平均反应速率为___________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
按要求填空:
(1)0.2molO3和0.3molO2的质量(选填“相等”、“不相等”或“无法判断”),分子数之比为,所含原子数之比为,在相同条件下的体积之比为。
(2)73g HCl气体中含有个分子,标准状况下占有的体积为L。
(3)相同物质的量浓度的KCl、CuCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3︰2︰1时,三种溶液的体积比为。
(4)标准状况下V L氯化氢气体溶解在1L水中,所得溶液的密度为ρg/mL,溶液中溶质的质量分数为ω,物质的量浓度为c mol/L,则ω=(任写一种表达式)。
按要求填空:
(1)除去NaHCO3溶液中的少量Na2CO3的离子方程式为:。
(2)呼吸面具中发生反应的化学方程式为:。
(3)由铝盐制取氢氧化铝的离子方程式为:。
(4)白色的Fe(OH)2在空气中发生的颜色变化为。
(5)将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体的化学方程式为:。
有机物A的结构简式为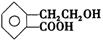 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
请回答下列问题:
(1)指出反应的类型:A→C:。
(2)在A~E五种物质中,互为同分异构体的是(填代号)。
(3)写出由A生成B的化学方程式
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(5)C能形成高聚物,该高聚物的结构简为。
(6)写出D与NaOH溶液共热反应的化学方程式
。
(9分)、下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是,氧化性最强的单质是,还原性最强的单质是;
(2)最高价氧化物的水化物碱性最强的是,酸性最强的是,呈两性的是;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的;
(4)在B、C、D、E、F、G、H中,原子半径最大的是.
(1)下列实验方法合理的是(多选或错选不给分)
| A.用加热法除去食盐固体中的氯化铵 |
| B.将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取 |
| C.实验室制取Al(OH)3: 往AlCl3溶液中加入NaOH溶液至过量 |
| D.往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质 |
(2)SiO2广泛存在自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式
(3)铝是一种重要金属:铝与NaOH溶液反应的离子方程式为:
(4)将10.7g氯化铵固体与足量消石灰混合加热使之充分反应。生成气体在标准状况下的体积是L