常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
| A.某溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7时,则该溶液的pH一定为14-a |
| B.将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+) |
| C.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.常温下NaHSO3溶液的pH<7,溶液中c(SO32-)<c(H2SO3) |
对于反应mA(g)+nB(g) pC(g)+qD(g) 满足下列图象,根据下列图象判断的四种关系正确的()

| A.m+n>p+q,正反应放热 | B.m+n>p+q,正反应吸热 |
| C.m+n<p+q, 正反应放热 | D.m+n<p+q,正反应吸热 |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则()
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则()
| A.a<b | B.平衡向逆反应方向移动了 |
| C.平衡向正反应方向移动了 | D.物质B的质量分数增加了 |
在密闭容器中进行如下反应:X2(g)+Y2(g)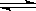 2 Z(g)。已知X2、Y2 Z的起始浓度分别为0.2mol/L、0.6mol/L、0.4mol/L,在一定条件下反应达到平衡,各物质的浓度有可能是()
2 Z(g)。已知X2、Y2 Z的起始浓度分别为0.2mol/L、0.6mol/L、0.4mol/L,在一定条件下反应达到平衡,各物质的浓度有可能是()
| A.X2为0.4mol/L | B.Y2为0.4mol/L | C.Z为0.6mol/L | D.Z为0.8mol/L |
过量的锌粉跟100mL 6mol/L H2SO4反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量。加入下列物质不能达到上述目的的是()
| A.把锌粉改为锌粒 | B.水 | C.Na2CO3固体 | D.降低反应体系温度 |
在温度压强不变的情况下,已知N2O4 2NO2,2mol N2O4在密闭容器内分解成NO2,到达平衡时生成了0.6mol NO2,则平衡时气体的总物质的量是()
| A.0.6mol | B.1.8mol | C.2.2mol | D.2.3mol |