已知下列热化学方程式:Zn(s)+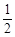 O2(g)=ZnO(s) △H =-351.1kJ·mol-1 ,Hg(l)+
O2(g)=ZnO(s) △H =-351.1kJ·mol-1 ,Hg(l)+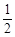 O2(g)=HgO(s) △H =-90.7 kJ·mol-1 由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为( )
O2(g)=HgO(s) △H =-90.7 kJ·mol-1 由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为( )
| A.-260.4 kJ·mol-1 |
| B.-441.8 kJ·mol-1 |
| C.260.4 kJ·mol-1 |
| D.441.8 kJ·mol-1 |
某同学研究铝及其化合物的性质时设计了如下两个实验方案。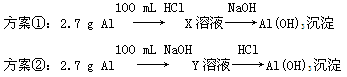
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是( )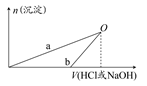
| A.b曲线表示的是向X溶液中加入NaOH溶液 |
| B.在O点时两方案中所得溶液浓度相等 |
| C.a、b曲线表示的反应都是非氧化还原反应 |
| D.X溶液显酸性,Y溶液呈碱性 |
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是( )
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如图所示,则该溶液中( )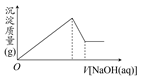
| A.有Mg2+,没有Al3+ |
| B.有Al3+,没有Mg2+ |
| C.有大量的H+、Mg2+和Al3+ |
| D.有Mg2+和Al3+ |
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
| A.甲、乙中都是铝过量 |
| B.甲中铝过量、乙中碱过量 |
| C.甲中酸过量、乙中铝过量 |
| D.甲中酸过量、乙中碱过量 |
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
| A.NH4+ NO3- CO32- Na+ |
| B.Na+Ba2+Mg2+HCO3- |
| C.NO3- K+AlO2- OH- |
| D.NO3- Ca2+K+Cl- |