用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| |
NaOH起始读数 |
NaOH终点读数 |
| 第一次 |
0.10mL |
18.60mL |
| 第二次 |
0.30mL |
18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: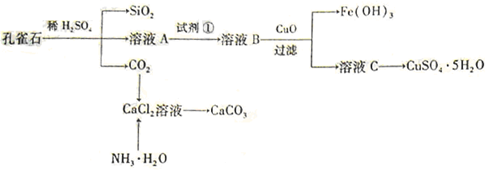
请回答下列问题:(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号 ),检验溶液A中Fe3+的最佳试剂为 (填代号)。
),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)由框图可知制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(4 )欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度。(填“偏高”、“偏低”、“无影响”。)
)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度。(填“偏高”、“偏低”、“无影响”。)
某课外活动小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净的氯气与氨气反应的装置。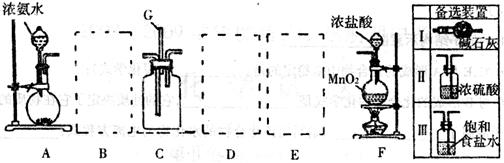
请回答下列问题:
(1)装置F中发生反应的离子方程式______________________________。
(2)装置A中烧瓶内固体可以选用__________(选填以下选项的代号)。
A.碱石灰 B.生石灰C.二氧化硅 D.氯化钙
(3)上图A—F是按正确实验装置顺序排列的。虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
B__________,D__________,E__________。
(4)C装置的反应原理可应用在检查输送氯气的管道是否漏气,写出检查输送氯气的管道是否漏气的化学方程式_______________________。请设计一个实验方案检验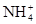 :
:
________________________________________________________________________。
(5)若从装置C的G处逸出的尾气中含有少量Cl2,写出尾气处理的离子方程式:
_____________________________________________________________。
I. 下列实验操作或对实验事实的描述不正确的是(填序号)
①分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③石油的分馏实验中,需将温度计的水银球插入液面以下以控制液体温度
④用瓷坩埚熔化各种钠的化合物
⑤测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照
⑥向NaOH溶液中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加NaOH溶液现象不同
⑦可用饱和碳酸氢钠溶液除去二氧化碳中混有的少量二氧化硫
II. (6分)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题: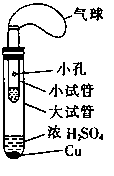
(1)写出制取SO2的化学方程式:。
(2)该反应中浓H2SO4表现的化学性质有。
(3)该同学利用实验现象来检验SO2的还原性,则选用的试剂为。
A.双氧水(H2O2) B.品红溶液 C.酸性高锰酸钾溶液
检验SO2还原性的试管中的现象为。
工业上常用铁质容器盛装冷的 浓酸。为研究铁质材料与热的浓硫酸的反应,某学习小组进行了以下探究活动:
浓酸。为研究铁质材料与热的浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷得浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y 。甲同学认为X中除Fe3+外还可能
。甲同学认为X中除Fe3+外还可能 含有Fe2+。若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是_。
含有Fe2+。若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是_。
乙同学认为气体Y中除含有SO2、H2外,还可能含有CO 2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
①认为气体Y中还含有CO2的理由是(用化学方程式表示)。
②装置A中试剂的作用是。
③为确认CO2的存在,需在装置中添加M于(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
④能说明气体Y中含有H2的实验现象是。
用18mol/L的浓硫酸配制100mL 1mol/L硫酸:
①用量筒量取浓硫酸的体积应为mL,将浓硫酸缓缓 倒入盛水的烧杯中后__ __(填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
倒入盛水的烧杯中后__ __(填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
②若实验仪器有: A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F. 胶头滴管 G. 50mL烧杯 H. 100mL容量瓶
实验时应选用的仪器有(填入编号)。
③定容时,若俯视液面,则所配溶液浓度 ____(填“偏高”、“偏低”或“无影响”);若不小心加水超过了容量瓶刻度线,应。
A.用胶头滴管将多余溶液吸出 B.加热容量瓶使水挥发 C.重新配制