在化学研究领域,经常需要对一些物质进行性质的确定。如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:

①准确称量m g金属镁(已除去表面氧化膜),用铜网包住放入干净的试管中;
②按图示组装好装置,然后在关闭活塞的分液漏斗中装入一定体积2 mol/L的盐酸;
③调整右边玻璃管(带均匀刻度值),让U型管两端液面在同一水平面,读出右边玻璃管的液面刻度值为V1mL;
④打开分液漏斗活塞,让一定量的盐酸进入试管中后立即关闭活塞;
⑤当镁条反应完后, ,读出右边玻璃管的液面刻度为V2 mL。
请回答下列问题:
(1)写出你认为步骤⑤中空格应进行的操作 。
(2)若V1,V2均是折算为标况下的值,则镁的相对原子质量Ar(Mg)的实验测定表达式为Ar(Mg)= ,你认为此表达式求出的值是否准确? (填‘是’或‘不’),主要问题为 (若回答‘是’则此空不填)。(2+1+1=4分)
(3)步骤①中,为什么要用铜网包住镁条? 。
(2分)下列实验操作或对实验事实的描述中正确的说法有。
①分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
②除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③将无水乙醇和3mol·L-1 H2SO4混合加热到170℃,可制得乙烯
④只用溴水就 可将苯、四氯化碳、乙醇、己烯四种液体区别开来
可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑤用分液法分离苯和硝基苯的混合物
测某种含有少量氧化钠的过氧化钠试样的质量分数。
方法一:利用下图装置测定混合物中Na2O2的质量分数,已知试样质量为1.560g、锥形瓶和水的质量为190.720g,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式________________
(2)该试样中过氧化钠的质量分数为____________________(保留3位有效数字)
不必作第6次读数的原因是____________________________________
方法二:测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
(3)操作Ⅱ的名称是________________________
(4)需直接测定的物理量是______________________________
(5)测定过程中需要的仪器有电子天平、蒸发皿、酒精灯、还需要________、_______(固定、夹持仪器除外)
(6)在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果__________________
(填偏大、偏小或不变)。
方法三:请从下图中选用适当仪器测定混合物中Na2O2的质量分数,要求操作简单。
除待测试样外,限选试剂:CaCO3固体,6mol/L盐酸和蒸馏水
(7)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)__________________。
某化学兴趣小组拟采用下图装置甲电解饱和氯化钠溶液,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量Ar(Cu),同时检验氯气的氧化性,图中夹持和加热仪器已略去。
(1)写出装置甲中反应的离子方程式:。
(2)为完成上述实验,正确的连接顺序为a连,b连(填写连接的字母)。
(3)装置乙中第一个广口瓶内的溶液不能是()
| A.淀粉碘化钾溶液 | B.NaOH溶液 |
| C.FeCl2与KSCN混合溶液 | D.Na2SO3溶液 |
(4)在 对硬质玻璃管里的氧化铜粉末加热前,需进行的操作为。
对硬质玻璃管里的氧化铜粉末加热前,需进行的操作为。
(5)装置丙中广口瓶内盛放的试剂为,作用是。
(6)为了测定Cu的相对原子质量,某同学通过实验测得丙装置反应前后如下数据:样品质量为m1g、反应后硬质玻璃管中剩余固体质量为m2g、反应前后U型管及其中固体质量差为m3g、反应前后洗气瓶及其中液体质量差为m4g。
①请选择理论上误差最小的一组数据计算Ar(Cu),Ar(Cu)=。
②如果选用其他组数据进行计算,会导致Ar(Cu)(填“偏大”、“偏小”或“不受影响”),理由是。
用如图装置制取乙酸乙酯,回答以下问题:
(1)饱和碳酸钠溶液除了吸收乙醇外的作用
(2)若选用含18O的乙醇, 则该反应的化学方程式是
则该反应的化学方程式是
(3)生成乙酸乙酯的密度水(填“大于”或“小于”)
(4)导气管能否插入液面以下(填“能”或“否”)
(5)若反应温度维持1400C左右时副反应产生的主要有机物是(结构简式)
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”中得到一些认识,其实验小组设计了如图所示装置。试回答下列问题: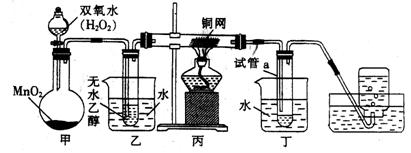
①甲中发生反应的化学方程式为。
②实验过程中铜网出现红色和黑色交替现象,请写出相应的化学方程式,从该实验现象中可以认识到实验过程中的催化剂(填“参加”或“不参加”)化学反应。当装置丙中反应进行一段时间后,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是(填“吸热”或“放热”)反应。
③乙、丁两个水浴装置的作用不同,乙中的作用是。
④反应进行一段时间后,试管a中能收集到的液体物质中可能含有。