下列物质在生活中应用时,起氧化作用的是
| A.明矾作净水剂 |
| B.漂粉精作消毒剂 |
| C.甘油作护肤保湿剂 |
| D.铁粉作食品袋内的脱氧剂 |
下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )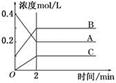
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是()
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是()
| A.v(CO)=1.5 mol·L-1·min-1 | B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 | D.v(CO2)=1.1 mol·L-1·min-1 |
下列说法中正确的是( )
| A.6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同 |
| B.常温下铁、铜均不溶于浓硫酸, 说明常温下铁、铜与浓硫酸均不反应 |
| C.离子化合物中只含离子键 |
| D.中子数为18的氯原子可表示为18Cl |
一定条件下,将A、B、C三种物质各1 mol通入一个密闭容器中发生反应:2A+B 2C,达到化学反应限度时,B的物质的量可能是( )
2C,达到化学反应限度时,B的物质的量可能是( )
A.1.5 mol B.1 mol C.0.5 mol D.0
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液,B不易腐蚀。将A、D在稀盐酸中构成原电池,电流由A通过导线流向D。将铜浸入B的盐溶液中,无明显变化。如果把铜浸入C的盐溶液中,有金属C析出。这四种金属的活动性由强到弱的顺序是( )
A.DCAB B.DABCC.DBAC D.BADC