已知:R-CH=CH-O-R′(烃基烯基醚)  R-CH2CHO + R′OH,烃基烯基醚A的相对分子质量(M r)为176,分子中碳氢原子数目比为3∶4。与A相关的反应如下
R-CH2CHO + R′OH,烃基烯基醚A的相对分子质量(M r)为176,分子中碳氢原子数目比为3∶4。与A相关的反应如下
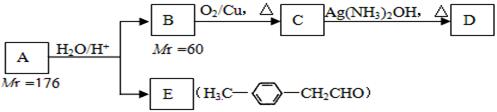
请回答下列问题:
(1)A的结构简式为__________;
(2)B的名称是__________;B→C的反应类型是__________;
(3)写出C→D反应的化学方程式:___________________________;
(4)写出两种同时符合下列条件的E的同分异构体的结构简式:_________、________。
① 属于芳香醛; ②苯环上有两种不同环境的氢原子
(5)写出由E转化为对甲基苯乙炔(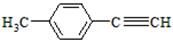 )的合成路线流程(无机试剂任选)。合成路线流程图示例如下:
)的合成路线流程(无机试剂任选)。合成路线流程图示例如下: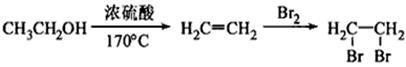
__________________________ _ 。
(6)请写出你所写出的流程图中最后一步反应的化学方程式_______________。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中
①X极上的电极反应式为,在X极附近观察到的现象是。
②Y极上的电极反应式为,检验该电极反应产物的方法是。
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是,电极反应式是。
② Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
⑴目前出现的“不粘锅”是表面有一种叫做“特氟龙”的涂层,实际就是号称”塑料王”的聚四氟乙烯,试写出合成“特氟龙”的化学方程式和反应类型。
方程式反应类型
⑵请写出硬脂酸甘油酯制肥皂的化学方程式和反应类型。
方程式反应类型
⑶请写出苯与浓硝酸反应的化学方程式和反应类型。
方程式反应类型
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)已知 2CH3CHO+O2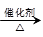 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。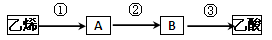
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_________________ ________________,反应类型是______________。
下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
| IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 二 |
① |
② |
③ |
④ |
||||
| 三 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______ (填元素符号),判断的实验依据是________________________________________________ (写出一种)。
下列3种不同粒子 H、
H、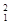 H、
H、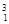 H表示______种元素,______种核素,
H表示______种元素,______种核素, H、
H、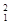 H、
H、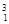 H互称为__________________。
H互称为__________________。