某同学研究铝及其化合物的性质时设计了如下两个实验方案:
方案①:2.7gAl  X溶液
X溶液 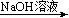 Al(OH)3沉淀
Al(OH)3沉淀
方案②:2.7gAl 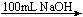 Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
NaOH溶液和稀盐酸的浓度均是3 mol/L,下图是向X溶液中加入NaOH溶液和向Y溶液中加入稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
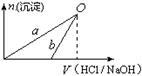
| A.X溶液的溶质为AlCl3,Y溶液的溶质为NaAlO2 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.在O点时两方案中所得溶液的物质的量浓度相等 |
| D.a、b曲线表示的反应都是氧化还原反应 |
用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2 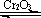 2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol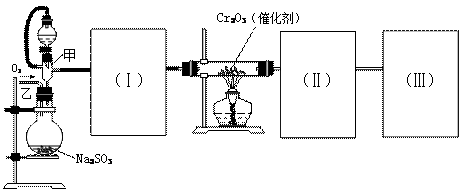
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接1个合适的装置,请从下列A~E中选择适宜的装置,将其序号填入空格内。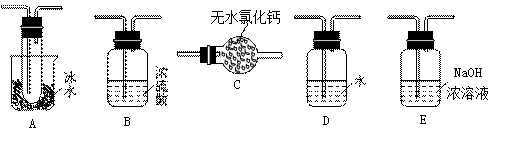
Ⅰ 、Ⅱ 、Ⅲ 。
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是: 。
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,若用大火加热有Cr2O3处的反应管时,SO2的转化率会 (填升高、降低或不变)
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加13.68g,则本实验中SO2的转化率为 。
25.用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入 Ba(OH)2溶液体积(V)间的关系图正确的是
为除去混在氯化钾中的少量硫酸钾和氯化钙杂质,需进行下列六项操作:
①加水溶解;②加热蒸发结晶;③加入过量氯化钡溶液;④加入过量盐酸;⑤加入过量碳酸钾溶液;⑥过滤。下列操作顺序正确的是
| A.①③⑤⑥④② | B.①⑤③④⑥② | C.①③④⑥⑤② | D.①⑤③⑥④② |
已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g )  2NH3 ( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
2NH3 ( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
| A.一定小于92.0 kJ | B.一定等于92.0 kJ | C.不能确定 | D.一定大于92.0 kJ |
.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+)。下列叙述正确的是
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量减少与阴极质量增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和 Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |