某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究,查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成.回答下列问题:

(1)仪器组装完成后,夹好止水夹,__________________,则说明装置A的气密性良好。
(2)从下列实验步骤中,选择正确的操作顺序:_____________________(填序号)。
①打开止水夹 ②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是________。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体证明样品中一定含有________,写出产生上述气体的化学方程式_______________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体3.2g,测得滤液中Fe2+有1.0 mol,则样品中n(Cu2O)=_______________mol。
两个学习小组用题图装置探究乙二酸(
)受热分解的部分产物。
(1)甲组:
①按接口顺序:
连接装置进行实验。
中溶液变浑浊,证明分解产物有;装置
的作用是;
中溶液变浑浊,
中的现象是,证明分解产物有。
②乙二酸受热分解的化学方程式为。
(2)乙组:
①将接口
与
连接进行实验,观察到
中生成的气体可使带火星的木条复燃,则
中最主要反应的化学方程式为。
②从
中选用装置进行实验,证明甲组通入
的气体能否与
反应。最简单的装置接口连接顺序是;实验后用
中的固体进行验证的方法是(可另选试剂)。
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示)。
| 砝码质量/g |
50 |
20 |
20 |
10 |
5 |
| 取用砝码情况 |

(2)图2表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是__________mL。
(3)配制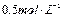 的硫酸溶液200mL所需的玻璃仪器为___ ___。
的硫酸溶液200mL所需的玻璃仪器为___ ___。
甲乙两位同学分别用不同的方法配制100mL 3.6mol/L的稀硫酸。
(1)若采用18mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为 。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是 。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是__ _______。
③定容的正确操作是 。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填序号)。
| A.吸出多余液体,使凹液面与刻度线相切 |
| B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切 |
| C.经计算加入一定量的浓盐酸 |
| D.重新配制 |
(3)乙学生:用100 mL 量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL 刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处 。
二氧化氯(
)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2比,
不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在
的制备方法中,有下列两种制备方法:
方法一:
↑
↑
方法二
↑
↑:
用方法二制备的
更适合用于饮用水的消毒,其主要原因是。
(2)用
处理过的饮用水(
为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(
)。2001年我国卫生部规定,饮用水中
的含量应不超过0.2
。饮用水中
、
的含量可用连续碘量法进行测定。
被
还原为
、
的转化率与溶液
的关系如图所示。
当
≤2.0时,
也能被
还原成
。
反应生成的I2用标准
溶液滴定:
①请写出
≤2.0时,
与
反应的离子方程式。
②请完成相应的实验步骤:
步骤1:准确量取
水样加入到锥形瓶中。
步骤2:调节水样的
为7.0~8.0。
步骤3:加入足量的
晶体。
步骤4:加入少量淀粉溶液,用
溶液滴定至终点,消耗
溶液
。
步骤5:。
步骤6:再用
溶液滴定至终点,消耗
溶液
。
③根据上述分析数据,测得该饮用水样中
浓度为
用含字母的代数式表示)
④若饮用水中
的含量超标,可向其中加入适量的
将
还原成
,该反应的氧化产物是(填化学式)。
纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是。若其它操作不变,将A与C连接,可观察到的现象是。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3 g白色固体,该白色固体的组成是(写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
| 实验操作 |
实验现象 |
结论 |
|
| ① 取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
|||
| ② 过滤,取2 mL滤液于试管中 |
|||
| ③ |
|||
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知NaHCO3在低温下溶解度较小。反应I为:
NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下。
NaHCO3↓+NH4Cl,处理母液的两种方法如下。
① 向母液中加入石灰乳,可将其中循环利用,同时得到融雪剂。
② 向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:_______________________________________。