300℃下,将2 mol SO2 1 mol O2混合于2 L的恒容密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
2SO3(g) ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
(1)能证明反应已经达到平衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2v(SO3)= v(O2)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(2)如图表示该反应的速率(v)随时间(t)的变化的关系:

据图分析:你认为t3时改变的外界条件可能是________;t6时保持体积不变向体系中充入少量He气,平衡 移动。(填“向左”“向右”或“不”)。SO2%含量最高的区间是
(t0~t1,t2~t3,t3~t4,t5~t6)。
(3)300℃时,该反应的平衡常数为 ,若升高温度该反应的平衡常数减小,则ΔH 0(填“大于”小于“或“不确定”)
(4)如果在相同条件下,上述反应从逆反应方向进行,开始时加入SO20.6 mol加入SO31.4 mol,若使平衡时各物质的量浓度与原来平衡相同,则还应加入O2 mol。
现有下列电解质溶液:①Na2CO3②NaHCO3  ④CH3COONH4
④CH3COONH4
⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)
(2)已知酸性 。常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号)>>
。常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号)>>
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH7(填>、=或<)理由是
已知由短周期元素组成的A、B、C、D四种化合物所含原子数目依次为2、3、4、5,其中A、B、C、含有18个电子,D含有10个电子。请回答
(1)A、B、D的化学式分别是A;B;D
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式。
(3)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,写出化学方程式。
若C为第一和第二周期元素组成的化合物,则
①C的溶液中加入少量的二氧化锰,有无色气体生成,写出化学方程式
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做剂
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:。
已知:2SO3 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间AB(大于;等于;小于);达平衡时SO3的转化率
AB(大于;等于;小于)。
(2)若平衡后,向A、B中分别充入惰性气体,容器的平衡将向方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A,B
[化学——选修有机化学基础]
某化合物A在一定条件下能发生如下图所示的转变: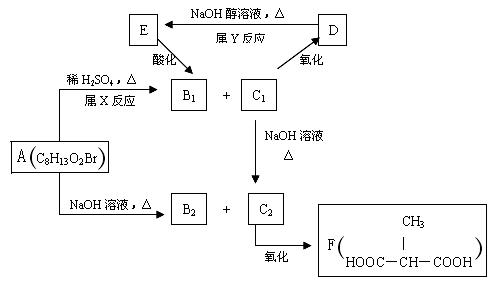
其中只有B1既能使溴水褪色,又能与Na2CO3溶液反应放出CO2,回答下列问题:
(1)指出反应类型:X反应,Y反应。
(2)物质A的结构简式为。
(3)写出C1 C2的化学方程式。
C2的化学方程式。
(4)与F互为同分异构体(分子中无环状结构)且核磁共振氢谱只有一种峰的有机物的结构简式有。(写一种)
(5)与C2具有相同官能团的同分异构体(不包括C2,同个碳原子上不能有多个羟基)共有种。
[化学一一选修物质结构与性质]
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示。请回答下列问题。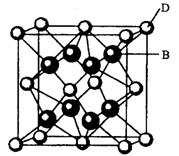
(1)E元素原子基态时的电子排布式为;
(2)A2F分子中F原子的杂化类型是,F的氧化物FO3分子空间构型为;
(3)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3·H2O的合理结构(填字母代号),推理依据是:
,试判断CA3溶于水后,形成CA3·H2O的合理结构(填字母代号),推理依据是:
。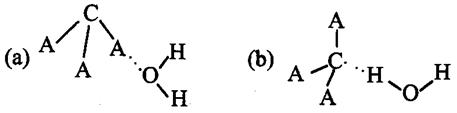
(4)从图中可以看出,D跟B形成的离子化合物的化学式为;该离子化合物晶体的密度为ag·cm-3。,则晶胞的体积是(写出表达式即可)。