废旧显示屏玻璃种含有SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O],流程设计如下:

已知:Ⅰ.酸性条件洗,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)反应②中过氧化氢的作用是 。
(2)反应③的离子方程式是 。
(3)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2 Ce3+(水层)+6HT(有机层) ≒2 CeT3 (有机层) +6H+(水层)
从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是 。
(4)硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
(5)相同物质的量浓度的以下三种溶液中,铵根离子浓度由大到小的顺序是 。
a.Fe2(SO4)3·(NH4)2SO4·24H2O b.(NH4)2SO4 c.(NH4)2CO3
(6)用滴定法测定制得的Ce(OH)4产品纯度。

若所用硫酸亚铁溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”);称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量氢氧化钠溶液,过量洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L硝酸钡溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色。请回答以下问题:
(1)A元素在元素周期表中位于周期族,C的化学式是______________。
(2)写出D与E反应转化为F和B的化学方程式________________________________。
(3)在常温下,B的稀溶液也可与Cu反应生成F。此反应的离子方程式:
。
右下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)在卡片上,叙述合理的是__________________(填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是____________________________________________________。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因________________。
(4)如果把硫酸换成硫酸铜溶液,猜测_________(填“锌极”或“铜极”)变粗,原因是__________________(用电极方程式表示)。
下表为元素周期表的一部分,请参照元素①-⑧
在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA[ |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_____________。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是。(填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次___________。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:,形成的晶体是晶体。
已知一定条件下,CO(g) + H2O (g)  CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为反应(填“吸热”或“放热”),反应的热化学方程式为:。
CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为反应(填“吸热”或“放热”),反应的热化学方程式为:。
将下列物质进行分类:①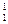 H与
H与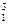 H②O2与O3③乙醇(C2H5OH)与甲醚(CH3—O—CH3)④正丁烷与异丁烷⑤C60与金刚石
H②O2与O3③乙醇(C2H5OH)与甲醚(CH3—O—CH3)④正丁烷与异丁烷⑤C60与金刚石
(1)互为同位素的是(填编号、下同);
(2)互为同素异形体的是;
(3)互为同分异构体的是;