淡水是一种重要的自然资源,是人类赖以生存不可缺少的物质。按要求回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是___________(填一种物质的名称),其净水作用的原理是_________________________ ____。混凝剂难以清除溶解于水中的有机物、无机物、微生物,混凝剂沉淀后还需要_____________。
(2)硬水的软化指的是_________________________ ____________________________ ___。
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_____________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2____________g, 后加入Na2CO3___________g 。
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极。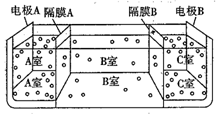
①隔膜A是_________(填“阴”或“阳”)离子交换膜。
②某种海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为________________________。
已知HIO呈两性,其碱式电离方程式为_________________________,若它与盐酸反应,则反应的方程式为___________________________。
将铁与氧化铁的混合物15g加入150mL稀硫酸中,在标准状况下生成1.68LH2,同时固体物质全部溶解,向溶液中加入KSCN溶液,未见颜色改变。为中和过量的硫酸且使铁全部转化为Fe(OH)2,共消耗3mol/LNaOH溶液200mL,则原硫酸溶液物质的量浓度为 ( )
| A.2mol/L | B.1.8mol/L | C.4mol/L | D.2.2mol/L |
下面是有关物质的转化关系图(有些物质己省略),其中A为单质,E在常温下为液体,D是一种含氧的化合物,请回答相关问题。
(1)若C的式量为78,则对C的结构、性质推断中不正确的是_____
A.久置于空气中会变成白色
B.具有强的氧化性
C.晶体存在离子键与非极性键
D.与湿润的紫色石蕊试纸接触时,只能使试纸变蓝色
(2)A的原子结构简图______________,H的电子式___________,E的结构式_________
(3)若C也是含氧化合物且氧为18O时,写出C与D反应的方程式___________________
_______________,另一产物(D以外)的摩尔质量为______。
(4)当A量较少时,I不可能是____________
A.H2O B.NaCl(aq) C.NaOH(aq) D.CuCl2
(5)若没有E在常温下为无色液体的限制,则E、I还可分别是_________、_________(填物质名称)
同学们吃的零食的包装袋中经常有一个小纸带,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂的理由是(用化学方程式表示)______________________________。
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸带中的物质能否长期持续地做干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些可以用作干燥剂?举出一例。
在一定条件下,RO3 n-和 I-发生的离子方程式如下:
RO3 n-+ 6I- + 6H+ ="=" R- + 3I2 + 3H2O
(1)RO3n-中R元素的化合价是_____________
(2)R元素的原子最外层电子数是________。