常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是
| 氢氰酸(HCN) |
碳酸(H2CO3) |
氢氟酸(HF) |
| K = 6.2×10-10 |
Ka1= 4.2×10-7 |
K=6.61×10-4 |
A.氟化钠溶液中通入CO2:2F-+H2O+CO2=2HF+CO32-
B.NaCN与HCN的混合溶液中:2c(Na+) = c(CN-)+ c(HCN)
C.0.2mol•L-1HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液的pH>7
D.25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者
某固体A在一定条件下加热分解,产物全是气体,A的分解反应为:2A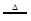 B+2C+2D,现测得分解产生的混合气体对氢气的相对密度为d,则A的相对分子质量为
B+2C+2D,现测得分解产生的混合气体对氢气的相对密度为d,则A的相对分子质量为
| A.2d | B.10d | C.5d | D.0.8d |
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
己知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O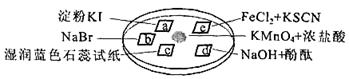
对实验现象的“解释或结论”正确的是
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+ > Cl- |
科学家刚刚发现了某种元素的原子,1个该原子质量是a g,一个12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
①该原子的相对原子质量为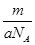
②m g该原子的物质的量为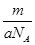 mol
mol
③该原子的摩尔质量是aNA g
④Wg该原子中含有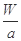 个该原子
个该原子
⑤由已知信息可得: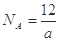
| A.①②④ | B.②③④ | C.①②⑤ | D.①③⑤ |
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液
②过量NaOH溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液
④Na2O2投入FeCl3溶液
| A.①④ | B.②③④ | C.②③ | D.①③④ |
某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
| A.NH4+、Fe2+、Cl-、SO42- | B.Na+、K+、Cl-、SO42- |
| C.Mg2+、H+、Cl-、SO42- | D.K+、Ca2+、HCO3-、Cl- |