Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4) C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
(28分)
[1]由碳、氢、氧三种元素组成的某有机物分子中共含有13个原子,其原子核外共有40个电子,l mol该有机物在氧气中完全燃烧时需消耗5.5 mol O2。请回答:
(1)试求出该有机物的分子式为 。
(2)若该有机物可使溴水褪色,且分子中不含有甲基,也不能发生银镜反应,取0.1 mol该有机物与足量钠反应,能产生1.12 L H2(标准状况),则该有机物的结构简式可能是 ;该有机物在一定条件下发生聚合反应的化学方程式是 。
(3)若该有机物能发生银镜反应,且分子中只含有一个甲基,则其结构简式是 。
(4)若该有机物的结构呈环状,且既不含甲基又不含羟基,则其键线式是 。
[2]2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为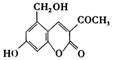 ,它配以辅料丙二
,它配以辅料丙二
|
醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为。
(3)验证滤液B含Fe3+,可取少量滤液并加入(填试剂名称)。
(4)滤液E中溶质的主要成份是(填化学式),写出该物质的一种具体用途。
(5)已知298 K时,Mg(OH)2的容度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+) =。
提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空: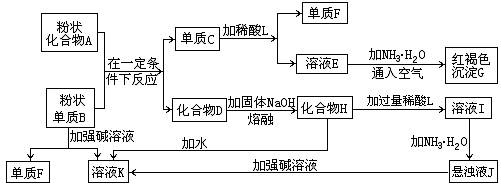
(1)单质F是_____________________。
(2)由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C转化为E、F若改用浓酸,则不能选用的浓酸是(写分子式)______________。
A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如下图所示。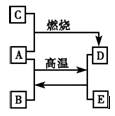
(1)写出A、B、C的化学式:
A___________________;B_________________;C______________。
(2)写出A、B转化为D、E的化学方程式_____________________________________。
(3)写出A与足量稀硝酸反应的离子方程式___________________________________。
若把Fe3O4看成“混合氧化物”时可以写成FeO•Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2。根据化合价规则和这种书写方法,Pb3O4可以分别写作
和。等物质的量的Fe3O4和Pb3O4分别和浓盐酸反应时,所消耗HCl的物质的量相等,不同的是,高价的铅能将HCl氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式,
。