在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni (s)+4CO (g)  Ni(CO)4 (g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4 (g),已知该反应平衡常数与温度的关系如表:
| 温度/℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10﹣5 |
下列说法不正确的是
A. 上述生成Ni(CO)4 (g)的反应为放热反应
B. 25℃时反应Ni(CO)4 (g)  Ni (s)+4CO (g)的平衡常数为2×10﹣5
Ni (s)+4CO (g)的平衡常数为2×10﹣5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
常温下,若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ NH4+SO42-NO3- |
下列图中,能正确表示饱和H2S溶液中通入过量SO2后溶液导电情况的是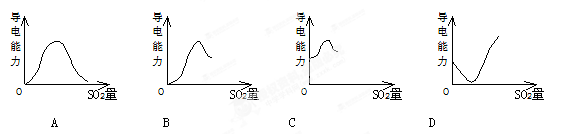
在0.1 mol·L-1 NH3·H2O溶液中存在如下电离平衡:NH3·H2O NH4+ + OH- 。对于该平衡,下列叙述中正确的是
NH4+ + OH- 。对于该平衡,下列叙述中正确的是
| A.加入水时,溶液中c(OH-)/ c(NH3·H2O)增大 |
| B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大 |
| D.降低温度,溶液中c(NH4+)增大 |
等体积、等物质的量浓度的盐酸和醋酸比较,下列说法错误的是
| A.溶液中pH醋酸比盐酸大 |
| B.与足量的锌粉反应产生的氢气体积相同 |
| C.与足量锌粒反应时,一开始盐酸的速率快 |
| D.能中和NaOH溶液的物质的量醋酸较少 |