某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。 ②该反应的气体产物是CO。
③该反应的气体产物是________
设计方案如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

(2)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:________________________。
(3)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20 g氧化铁、2.00 g碳粉混合均匀,放入48.48 g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24 g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00 g。
步骤②、④中都分别通入N2,其作用分别为____________
(4)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:______________。
(5)实验反思
学习学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是__________________。
②此装置存在一定缺陷,请你指出___________________________。
硼镁矿属于硼酸盐,可用来制备硼酸(H3BO3)和MgO,方法如下:硼镁矿粉与(NH4)2SO4溶液混合后加热,反应生成H3BO3晶体和MgSO4溶液,同时放出NH3;再向MgSO4溶液中通入NH3与CO2,得到MgCO3沉淀和滤液,沉淀经洗涤、煅烧后得MgO,滤液则循环使用。回答下列问题:
(1)与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式。
(2)上述制备过程中,检验沉淀洗涤是否完全的方法是。
(3)写出MgSO4溶液中通入NH3与CO2反应的化学方程式。
(4)若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g,MgO 0.8 g,计算该硼酸盐的组成。(写出计算过程)
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成: 
实验步骤如下:
①如图1所示,在三颈烧瓶中加入A,1.5 g镁屑,在滴液漏斗中加入,6.7 mL溴苯和无水乙醚,先加人1/3混合液于烧瓶中,待镁屑表面有气泡产生时,开始搅拌,并逐滴加入余下的混合液,使反应液保持微沸状态,至反应完全。
②继续加,A,3.7 g苯甲酰氯和无水乙醚,水浴回流l h 后,在冷水浴下慢慢滴加氯化铵的饱和溶液30.0 mL。
③将三颈烧瓶内的物质水浴加热蒸去乙醚,然后加,A,30.0 mL水进行水蒸气蒸馏(图2用作水蒸气发生装置),直至无油状物蒸出。
④冷却抽滤,将固体用80.0%的乙醇溶液重结晶,最终得到产品。
(1)步骤①中“逐滴加入余下的混合液”是为了防止 。
(2)若水蒸气蒸馏装置中出现堵塞现象,则图2玻璃管中水位会突然升高,此时应 ,待故障排除后再进行蒸馏。
(3)抽滤用到的主要仪器有气泵、,抽滤优于普通过滤的显著特点是。
(4)步骤④中用80.0%的乙醇溶液重结晶的目的是。
(5)用光谱法可检验所得产物是否纯净,其中用来获得分子中含有何种化学键和官能团信息的方法。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、K1O3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为。
②操作A包括;用冰水洗涤的目的是。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是,
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比(选填“增大”、“减小”或“不变”)。
电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。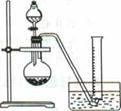
实验原理:CaC2 +2H2O==Ca(OH)2+C2H2 ↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①称取样品1.2g;
②把1.2g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有24mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、、、。
(2)若实验前有1000mL、500 mL、250 mL的量筒备用,则应选用mL的量筒。
(3)生成气体体积是mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,反应的化学方程式为□KMnO4+□C2H2+□H2SO4——□K2SO4+□MnSO4+□CO2+□。若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol·L-1的KMnO4溶液mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为。
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
| ② |
先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 |
应该观察到的现象 |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:。
实验3:进行实验以确定可能的原因。
| 操作 |
现象 |
| 向试管②所得溶液中继续加入0.5 mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN 溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN 溶液 |
静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:。