K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,溶于水,难溶于乙醇,110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。
实验室利用(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
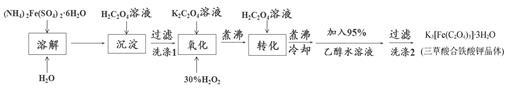
已知:沉淀: FeC2O4·2H2O既难溶于水又难溶于强酸
6FeC2O4+3H2O2+6K2C2O4 4K3[Fe(C2O4)3]+2Fe(OH)3↓
4K3[Fe(C2O4)3]+2Fe(OH)3↓
2Fe(OH)3+3H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
(1)检验硫酸亚铁铵是否变质的试剂是 ;溶解时加几滴稀硫酸的目的是 。
(2)沉淀过滤后,洗涤1的操作方法是 。
(3)在沉淀中加入饱和K2C2O4溶液,并用40 ℃ 左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程需保持温度在40 ℃ 左右,可能的原因是 。加入30%过氧化氢溶液完全反应后,煮沸的目的是 。
(4)洗涤2中所用洗涤试剂最合适的是 (填选项字母)。
| A.草酸钠溶液 | B.蒸馏水 | C.乙醇 | D.KCl溶液 |
7.4 g有机物A完全燃烧生成8.96 L CO2(标准状况下)和9 g水,有机物B是A的同系物,1 mol B完全燃烧消耗氧气的物质的量比1 mol A完全燃烧消耗氧气的物质的量多1.5 mol,B能与Na反 应生成H2。
应生成H2。
(1)A的分子式为________,B的分子式为________。
(2)若A不能发生催化氧化反应,则A的结构简式为________,若B不能发生消去反 应,则B的结构简式为________________。
应,则B的结构简式为________________。
(3)若A、B的另外一种同系物C既不能发生催化氧化反应,也不能发生消去反应,则C至少有________个碳原子。
如表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。 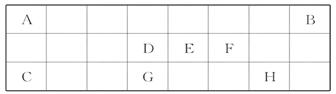
(1)上述元素的单质中熔点最高的可能是______(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是______ ____
____
的缘故。
(3)在一定条件下,A 与E可形
与E可形 成一种极易溶于水的气态化合物,其电子式为_______;该物质溶于水后的溶液呈_______性(填“酸”、“碱”或“中”)。
成一种极易溶于水的气态化合物,其电子式为_______;该物质溶于水后的溶液呈_______性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中_____族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的_____ (填元素符号)元素组成的,用化学方程式表示吸收原理__________________________。
乙烯、苯是重要的化工原料,请写出下列化学方程式及反应类型。
(1)一定条件下,乙烯与水反应的化学方程式
反应类型为
(2)在适当的温度、压强和有催化剂存在的条件下,乙烯可形成高分子化合物聚乙烯,该反应方程式为,反应类型为
(3)向溴的苯溶液中加入适量的FeBr3_______________________,反应类型_________
乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明是: 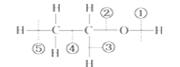
A.和金属钠反应时断裂键 B .在铜催化共热下与O2反应时断裂键
.在铜催化共热下与O2反应时断裂键
C.在消去反应时断裂键 D.在 酯化反应时断裂键
(2分)下列实验操作或对实验事实的描述中正确的说法有。
① 分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
② 除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③将无水乙醇和3mol·L-1 H2SO4混合加热到170℃,可制得乙烯
④只用溴水就可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑤用分液法分离苯和硝基苯的混合物