下列关于反应热的说法正确的是( )
| A.在稀溶液中所有酸和碱反应的中和热数值都相等 |
| B.已知C(s)+ O2(g)="CO(g)" △H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
下列说法中错误的是()
| A.SO2、SO3都是极性分子 |
| B.在H3O+和[Cu(H2O)4]2+中都存在配位键 |
| C.元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 |
| D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
下列关于物质结构与性质的叙述中,正确的是()
| A.氢键的存在一定会使物质的熔点升高 |
| B.因为蛋白质分子与胶体粒子大小相近,故蛋白质溶液具有胶体的某些性质 |
| C.丁达尔现象是胶体粒子对光线反射形成的,可以用于区分胶体和悬浊液 |
| D.可以用电子气理论解释大多数金属容易发生锈蚀的性质 |
下列说法错误的是()
| A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 |
| B.1 mol金刚石晶体中,平均含有2 mol C—C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如右图所示,该气态团簇分子的分子式为EF或FE |
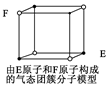
下列叙述正确的是()
| A.根据非金属原子最外层电子数的多少,可判断两种元素得电子能力的强弱 |
| B.具有相同电子层结构的微粒,其化学性质是相似的 |
| C.某变化过程中发生共价键的断裂,则该过程中一定发生化学变化 |
| D.含金属元素的离子不一定是阳离子,不含金属元素的离子可能是阳离子 |
用NA表示阿伏加德罗常数的值,下列说法中不正确的是()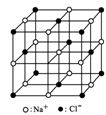
| A.7.8 g Na2O2与足量潮湿的CO2反应,转移的电子数为0.1 NA |
| B.标准状况下2.24 L HCHO中含0.4 NA个原子 |
| C.23.4 g NaCl晶体中含0.1 NA个如图所示结构单元 |
| D.CsCl 1mol含晶胞0.25NA个 |