下列说法正确的是
| A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.相同温度下,将足量氯化银固体分别加入:①蒸馏水、 ② 0.1 mol·L-1氯化镁溶液、③ 0.1 mol·L-1盐酸、④ 0.1 mol·L-1硝酸银溶液中,充分溶解后Ag+浓度:①> ③=④>② |
| C.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 |
| D.为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
钾和另一种碱金属组成的合金18.0 g与足量的水完全反应,产生氢气1 g,则合金中的另一种金属是
| A.Cs | B.Rb | C.Na | D.Li |
下列关于金属元素性质的叙述正确的是( )
A金属元素的原子只有还原性,离子只有氧化性
B金属元素在化合物中一定显正化合价
C金属元素在不同化合物中化合价一定是不同的
D金属元素的单质在常温下都是固体
下列离子方程式书写正确的是( )
A铝粉投入到NaOH溶液中2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉: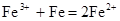
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
金属M在一定条件下既能跟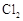 反应,又能跟稀盐酸反应,且均生成
反应,又能跟稀盐酸反应,且均生成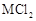 型化合物,则
型化合物,则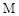 可能是
可能是
| A.Al | B.Fe | C.Cu | D.Mg |
下列反应中,不属于氧化还原反应的是( )
| A.CaCO3+2HCl====CaCl2+H2O+CO2↑ | B.H2+Cl2====2HCl |
| C.2Na2O2+2CO2====2Na2CO3+O2 | D.Fe+CuSO4====FeSO4+Cu |