恒温恒容条件下,可逆反应 达到平衡,下列叙述不是反应达到平衡的标志
达到平衡,下列叙述不是反应达到平衡的标志
① C的生成速率与C的分解速率相等
② 单位时间生成amolA,同时生成3amolB
③ A、B、C的浓度均不再变化
④ A、B、C的物质的量之和不再变化
⑤ 混合气体的总压强不再变化
⑥ 混合气体的密度不再变化
⑦ 单位时间内消耗a molA,同时生成3a molB
⑧ A、B、C的物质的量之比为1︰3︰2
A.⑤⑥⑧ B.③④⑦ C.①③⑥ D.②⑥⑧
图1为某化学反应的速率与时间的关系示意图。下列有关t1时刻改变条件的说法正确的是()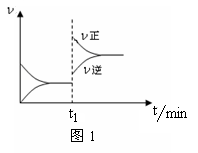
A.2SO2(g)+O2(g)  2SO3(g) ΔH<0,t1时刻升高温度 2SO3(g) ΔH<0,t1时刻升高温度 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度 |
C.H2O(g)+CO(g)  H2(g)+CO2(g) ΔH>0, t1时刻增大压强 H2(g)+CO2(g) ΔH>0, t1时刻增大压强 |
D.C(s)+H2O(g) CO(g)+H2(g) ΔH>0,t1时刻升高温度 CO(g)+H2(g) ΔH>0,t1时刻升高温度 |
COCl2(g) 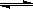 CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒压时通入惰性气体,能提高COCl2转化率的是()
CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒压时通入惰性气体,能提高COCl2转化率的是()
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
、化学反应C(s)+H2O(g) CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
| A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.加入固体碳,平衡向正反应方向移动 |
| C.减小压强,平衡向正反应方向移动 |
| D.加入水蒸气使容器压强增大,平衡向逆反应方向移动 |
下列事实,不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D.实验室用排饱和食盐水而不用排水法收集氯气 |
恒容密闭容器中进行的可逆反应2NO2 2NO+O2,可作为达到平衡状态的标志是
2NO+O2,可作为达到平衡状态的标志是
①单位时间内生成a mo1 O2的同时生成2a mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
| A.①③⑤ | B.②④⑤ | C.①③④ | D.①②③④⑤ |