298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) △H=-akJ/mol(a>0)。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol,n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
N2O4(g) △H=-akJ/mol(a>0)。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol,n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )

| A.v(正)>v(逆) | B.v(正)<v(逆) | C.v(正)=v(逆) | D.v(正)、v(逆)大小关系不确定 |
以下是一些常用的危险品标志,装运硝酸铵的包装箱应贴的图标是 ( )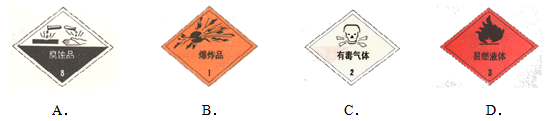
含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO)。下列有关判断正确的是()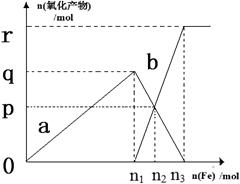
| A.a是Fe(NO3)2 | B.n1 = 0.80 | C.p = 0.60 | D.n3= 1.20 |
一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是()
①H2②CO③CO和H2的混合物④HCOOCH3⑤CH3CHO
| A.⑤ | B.①② | C.①②③④ | D.①②③④⑤ |
将50 mL某未知浓度的AlCl3溶液分别加到60 mL 1 mol·L-1的NaOH溶液或60 mL 3 mol·L-1的NaOH溶液中,均能得到1.56 g Al(OH)3沉淀。则此AlCl3溶液的浓度可能是()
| A.1 mol·L-1 | B.0.5 mol·L-1 | C.0.6 mol·L-1 | D.0.4 mol·L-1 |
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。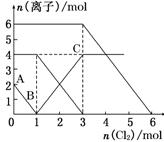
则下列有关说法中,不正确的是( )
| A.还原性:I->Fe2+>Br- |
| B.原混合溶液中FeBr2的物质的量为6 mol |
| C.当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |