下列说法不正确的是( )
| A.已知冰的熔化热为6.0 kJ﹒mol-1,冰中氢键键能为20 kJ﹒mol-1,假设1mol冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中30%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/C(1−a).若加入少量CH3COONa固体,则电离平衡CH3COOH CH3COO-+H+向左移动,a减小,Ka不变 CH3COO-+H+向左移动,a减小,Ka不变 |
| C.检测得环已烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ.mol-1、-3747 kJ.mol-1和-3265kJ.mol-1可以证明在苯分子中不存在独立的碳碳双键 |
| D.进行中和热反应中,如果不把温度计上的酸用水冲洗掉,那么根据cm△t计算得到的Q结果会偏小 |
下列晶体分类中正确的是一组是
| 离子晶体 |
原子晶体 |
分子晶体 |
|
| A |
NaOH |
Ar |
SO2 |
| B |
H2SO4 |
石墨 |
S |
| C |
CH3COONa |
水晶 |
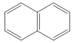 |
| D |
Ba(OH)2 |
金刚石 |
玻璃 |
氯化硼的熔点为-107℃、沸点为12.5℃,在氯化硼分子中,氯—硼—氯键角为120º,它可以水解,水解产物之一是氯化氢,下列对氯化硼的叙述中正确的是
| A.氯化硼是原子晶体 |
| B.熔化时,氯化硼能导电 |
| C.硼原子以sp3杂化 |
D.水解方程式:BCl3+3H2O H3BO3+3HCl H3BO3+3HCl |
原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征,下列各对粒子中,空间结构相似的是
①CS2与NO2②CO2与N2O③SO2与O3④PCl3与BF3
| A.①②③ | B.③④ | C.②③④ | D.②③ |
下列熔、沸点高低的比较不正确的是
| A.金刚石>碳化硅>晶体硅 | B.邻羟基苯甲酸>对羟基苯甲酸 |
| C.纯铁>生铁 | D.MgO>MgCl2 |
甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),在这个过程中,下列描述不合理的是
| A.碳原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 |
| C.微粒的稳定性发生了改变 |
| D.微粒中的键角发生了改变 |