已知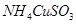 与足量的10mol/L硫酸液混合微热,有下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。下列说法正确的是( )
与足量的10mol/L硫酸液混合微热,有下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。下列说法正确的是( )
| A.反应中硫酸作氧化剂 | B.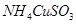 中硫元素被氧化 中硫元素被氧化 |
| C.刺激性气味的气体是氨气 | D.1mol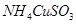 完全反应转移0.5mol电子 完全反应转移0.5mol电子 |
在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡
CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.溶液PH等于1 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)降低 |
| D.加入少量CH3COONa固体,平衡向左移动,导电能力不变 |
反应2SO2 + O2 2SO3在一定温度下达到平衡,下列说法正确的是
2SO3在一定温度下达到平衡,下列说法正确的是
| A.增大压强,平衡向右移动,平衡常数K增大 |
| B.增加O2的浓度平衡向右移动,SO2的转化率增大 |
| C.此时一定满足c(SO2) = 2c(O2) |
| D.平衡向右移动时反应物的浓度减少,生成物的浓度增加 |
下列反应的离子方程式正确的是
| A.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ |
| B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| C.碳酸钙溶于醋酸:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| D.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O |
NA代表阿伏加德罗常数,下列说法正确的是
| A.0.5 mol Fe与足量盐酸反应转移电子数为3NA |
| B.标准状况下,11.2 L SO3所含的分子数为0.5NA |
| C.0.5 mol CH4所含的电子数为1NA |
| D.28 g CO和N2的混合物含有的分子数为1NA |
某反应A+3B=2C+D在2min内A的浓度变化了2mol/L,则下列表示的化学反应速率正确的是()
A.υ(A)= 1 mol/(L·min) B.υ(B)= 6 mol/(L·min)
C.υ(C)= 4 mol/(L·min) D.υ(D)= 1 mol/(L·min)