控制适合的条件,将反应Fe3++Ag Fe2++Ag+ 设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是 ( )
Fe2++Ag+ 设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是 ( )
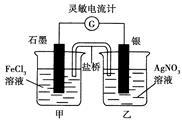
| A.盐桥中的K+移向乙烧杯 |
| B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| C.在外电路中,电子从石墨电极流向银电极 |
| D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
在一定温度和压强下,下列各可逆反应达到化学平衡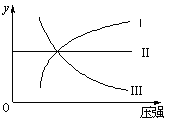
状态,各反应有如图所示的对应关系:
(1)N2(g)+3H2(g) 2NH3(g)△H<0(曲线Ⅰ)
2NH3(g)△H<0(曲线Ⅰ)
(2)H2(g)+I2(g) 2HI(g)△H>0(曲线Ⅱ)
2HI(g)△H>0(曲线Ⅱ)
(3)2SO3(g) 2SO2(g)+O2(g)△H>0(曲线Ⅲ)
2SO2(g)+O2(g)△H>0(曲线Ⅲ)
则图像中y轴可以表示()
①平衡混合气中一种生成物的体积分数②平衡混合气中一种反应物的体积分数③平衡混合气中一种生成物的产率④平衡混合气中一种反应物的转化率
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
已知某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,浓度均为0.1mol•L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系是()
| A.c(H+)•c(OH-) >1×10-14 |
| B.c(H+) + 2c(H3XO4)+ c(H2XO4-)=c(XO43-)+ c(OH-) |
| C.c(H+) + c(H3XO4)= c(HXO42-)+ 2c(XO43-)+ c(OH-) |
| D.c(Na+)+ c(H+)= c(H2XO4-)+ c(OH-)+ 2c(HXO42-)+ 3c(XO43-) |
2008年北京残奥会吉祥物是以牛为形象
设计的“福牛乐乐”(Funiulele)。有一种有机
物的键线式也酷似牛形(右图所示),故称为
牛式二烯炔醇(cowenyenynol)。
下列有关说法正确的是 ()
| A.该有机物的化学式为:C29H44O |
| B.牛式二烯炔醇含有5个手性碳原子 |
| C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应 |
| D.牛式二烯炔醇分子内能发生消去反应 |
下列反应的离子方程式错误的是()
| A.硫酸铝中加入过量浓氨水:Al3++4OH-====AlO2-+2H2O |
B.铜跟浓硝酸反应:Cu+2NO3-+4H+====Cu2++2NO2↑+2H2O |
| C.实验室用大理石跟稀盐酸反应制二氧化碳气体:CO32-+2H+====CO2↑+H2O | |
| D.用氯化铁溶液制作印刷电路板:Cu+2Fe3+====Cu2++2Fe2+ |
下列各项中的表达正确的是()
| A.含1个中子的氦原子为:12He | B.乙醛的结构简式为:CH3COH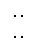 |
| C.H2O的结构式为:H—O—H | D.CH4的分子模型示意图为: |