短周期元素X、Y、Z、W的原子序数依次增大。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
| A.含有Y元素的可溶性盐溶于水一般都可以破坏水的电离平衡 |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.X、Y、Z原子半径由小到大的顺序是Y>Z>X |
| D.常温下,0.1 mol·L-1 W的气态氢化物的水溶液的pH>1 |
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是
| A.甲、乙中都是铝过量 | B.甲中铝过量、乙中碱过量 |
| C.甲中酸过量、乙中铝过量 | D.甲中酸过量、乙中碱过量 |
下列离子方程式正确的是()
| A.稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B.硫酸铝溶液中滴入氨水 Al3++3OH-=Al(OH)3↓ |
| C.碳酸氢镁溶液中加入氢氧化钠溶液 Mg2++2HCO3-+4OH-=Mg(OH)2↓+CO32-+2H2O |
| D.硝酸铝溶液中滴加少量的氢氧化钠溶液 |
Al3++3OH-=Al(OH)3↓
下列叙述中,正确的是:
A:某物质中只含有一种元素,该物质一定是纯净物。
B:某晶体中含有阳离子,则必定含有阴离子。
C:金属晶体的自由电子属整个晶体所共有。
D:金属晶体发生形变时其内部金属离子与自由电子的相互作用消失了。
将等物质的量的镁和铝相混合,取等质量的该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
| A.3 mol·L-1 HCl | B.4 mol·L-1 HNO3 |
| C.8 mol·L-1 NaOH | D.18 mol·L-1 H2SO4 |
CaC2和MgC2都是离子化合物,下列叙述正确的是
| A.MgC2和CaC2都能跟水反应生成乙炔 |
B.C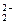 的电子式为[∶C┋┋C∶]2- 的电子式为[∶C┋┋C∶]2- |
C.CaC2在水中以Ca2+和C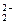 形式存在 形式存在 |
| D.MgC2的熔点低,可能在100 ℃以下 |