(碱式氧化镍 (Ni00H)可用作镍氢电池的正极材料。以含镍(Ni2+ )废液为原料生产 Ni00H的一种工艺流程如下:

(1)加入Na2C03溶液时,证明Ni2+已经完全沉淀的实验方法是 ,过滤时需用到的玻璃仪器有烧杯、 。
(2)写出碳酸镍与稀硫酸反应的离子方程式 : 。
(3)硫酸镍溶液可用于制备合成氨的催化剂C0ni(1-n) Fe204。
如图表示在其他条件相同时合成氨的相对初始速率随催化剂中w值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是 。

(4)写出在空气中加热Ni(0H)2NK0H)制取Ni00H的化学方程式: 。
已知乙醇的沸点为78.3℃,与水以任意比互溶,且在78.15℃时与水可形成95.57%(体积分数,下同)的恒沸混合物(即水和酒精可同时挥发)。酒精中的水可加入生石灰除去,反应如下:CaO+H2O====Ca(OH)2,CaO和Ca(OH)2均不溶于酒精。
某化学活动小组要用35%的酒精制取无水酒精,设计了如下四种方案。
方案一:对35%的酒精直接蒸馏得无水酒精。
方案二:先对35%的酒精蒸馏得95.57%的酒精,再加入生石灰,然后进行蒸馏得无水酒精。
方案三:用CCl4对35%的酒精进行萃取,然后对酒精的CCl4溶液进行蒸馏得无水酒精。
方案四:向35%的酒精中直接加入生石灰,然后进行蒸馏得无水酒精。
请对四种方案进行评价,回答下列问题:
(1)最好的方案是 ,错误的方案是 ,错误的原因是 。
(2)其余方案的不足是 。
(3)用最好的方案进行实验时,所用到的玻璃仪器有
。
(4)蒸馏操作中要注意的事项是
(回答三项即可)。
ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应2NaClO2+Cl2====2ClO2+2NaCl。
下图所示是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置省略)。其中E中盛有CCl4(用于除去ClO2中未反应的Cl2)。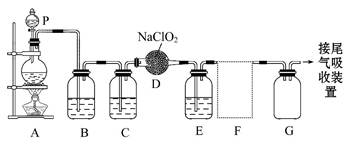
(1)仪器D的名称是 。
(2)写出装置A中烧瓶内发生反应的离子方程式:
。
(3)B装置中所盛试剂是 ,作用是______________________
(4)F处应选用的收集装置是 (填序号),其中与E装置导管相连的导管口是 (填接口字母)。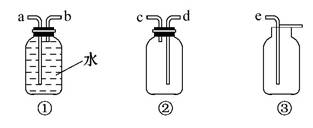
(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置是 。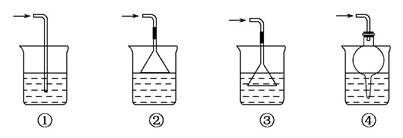
| A.①② | B.②③ | C.③④ | D.②④ |
下图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题: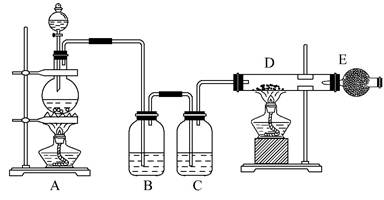
(1)盛放浓盐酸的仪器名称为 。
(2)烧瓶中发生反应的化学方程式为
。
(3)C瓶中的试剂是 ;其作用是
。
(4)玻璃管D中发生反应的化学方程式是
,
反应现象是 。
(5)干燥管E中盛有碱石灰(CaO+NaOH),其作用是
。
某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择 mL的容量瓶。
(2)其操作步骤如乙图所示,则甲图操作应在乙图中的 (填选项字母)之间。
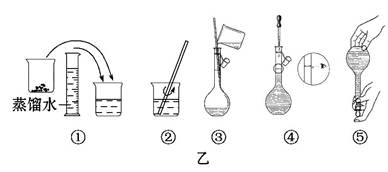
A.②与③ B.①与② C.③与④
(3)该同学应称取NaOH固体 g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在下图中选出能正确表示游码位置的选项 (填字母)。
附表 砝码规格
| a |
b |
c |
d |
e |
|
| 砝码大小/g |
100 |
50 |
20 |
10 |
5 |
用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量为 。
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O晶体失去了部分结晶水
②碳酸钠晶体不纯,其中混有氯化钠
③称量碳酸钠晶体时所用砝码生锈
④容量瓶未经干燥使用
其中引起所配溶液浓度偏高的有 (填序号,下同),偏低的有 ,无影响的有 。
(3)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示: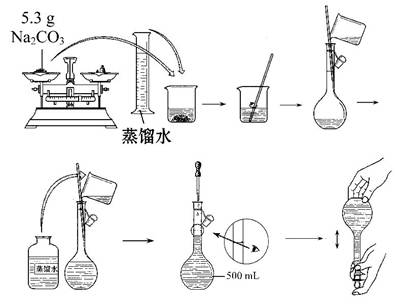
你认为该同学的错误步骤有 (填序号)。
| A.1处 | B.2处 | C.3处 | D.4处 |