将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应.求:
(1)6.50g锌的物质的量;
(2)反应中生成的H2在标准状况下的体积.
(3)所用盐酸中HCl中的物质的量浓度;
用黄铜矿炼铜按反应物和生成物可将总反应可以写成:
aCuFeS2 + bSiO2 + cO2 → dCu +e FeSiO3 + fSO2
(1)配平上述化学反应方程式:a =___b=___c=___d=___e=___f=___
(2)若2.5吨黄铜矿(含CuFeS280%)发生上述反应,计算生成的SO2在标准状况下的体积(m3)。
(3)若将标准状况下的SO2 280mL通入100mL碘水中充分吸收后,多余的碘用0.182mol/LNa2S2O3溶液滴定(I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6),用去Na2S2O3溶液5.50mL。写出SO2通入碘水中反应的离子方程式。
(4)计算(3)中碘水的物质的量浓度。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。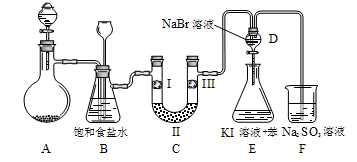
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:
。
(2)装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入。
| a |
b |
c |
d |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为深棕红色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是。该现象
(填“能”或“不能”)说明溴的非金属性强于碘,原因是。
(1)标准状况下,体积约为11.2 L的NH3中约含有个分子、含有个质子。
(2)同温同压下,同质量的氨气和硫化氢气体(H2S)的体积比为。同温同压下,若二者氢原子数相等,它们的体积比为。
(3)在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时密闭容器中气体分子总的物质的量增加了75%。则A单质的一个分子中有_____个A原子,AH3分解反应的化学方程式为___________________。
(5分)某研究性学习小组欲用化学方法测量一个不规则容器的体积。把46.8 g NaCl放入烧杯中,加入一定量的蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器。从中取出溶液100 mL,该溶液恰好与20 mL 0.1 mol·L-1 AgNO3溶液完全反应,计算该容器的体积
(5分)在标准状况下,将44.8LHCl溶于927mL水(密度为1g/cm3)中,所得盐酸的密度为1.05g/cm3,计算所得盐酸的溶质质量分数及物质的量浓度。