锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似.氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga在元素周期表中的位置________________________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为______________________。
(3) 下列有关镓和镓的化合物的说法正确的是_______________(填字母序号)。
A.一定条件下,Ga可溶于盐酸和氢氧化钠
B.常温下,Ga可与水剧烈反应放出氢气
C.Ga2O3可由Ga(OH)3受热分解得到
D.一定条件下,Ga2O3可与NaOH反应生成盐
II.工业上利用锌焙砂(主要含Zn0、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:

已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO•Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式 ______________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀.净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______________。
(6)净化II中加入Zn的目的是______________________。
Ⅲ.(7)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4•7H2O.

实验步骤如下:
①将锌片完全溶于稍过量的3mol•L-1稀硫酸,加入_______(选填字母,下同);
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入__________;
A.纯锌粉 B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol•L-1稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥.
其中步骤③加热的主要目的是__________________________。
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验.先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应
请你回答下列问题
(1)写出甲同学实验中两个主要的化学方程式、。
(2)甲同学设计的实验(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是 ___________(填字母)
| A.使溴水褪色的反应,未必是加成反应 | B.使溴水褪色的反应,就是加成反应 |
| C.使溴水褪色的物质,未必是乙炔 | D.使溴水褪色的物质,就是乙炔 |
(3)乙同学推测此乙炔中必定含有的一种杂质气体是,它与溴水反应的化学方程式是;在验证过程中必须全部除去。
(4)为验证这一反应是加成而不是取代,丙同学提出
可用pH试纸来测试反应后溶液的酸性,理由是
生活中有很多现象都蕴藏着化学秘密,如果你是一个细心的人,就一定会发现很多有趣的事。
(1)煤气灯曾是十八世纪的主要照明工具,但有一个奇怪的事引起了不少人的注意,那就是在有些煤气灯的附近,树叶比其他树要早落好长时间,但这个问题一直到1901年才由俄国的植物学家奈刘波夫证实是煤气灯产生的一种气体在作怪,你认为这种气体可能是________。(填物质名称)
(2)为了证明你的判断,下列是一位同学做的实验及其装置:
如果实验时无水硫酸铜变蓝色,澄清的石灰水变浑浊;你认为通过以上实验可以得出的结论是________________________________________________。
(3)若要进一步得出该分子的组成,另一个同学设计的实验及其装置: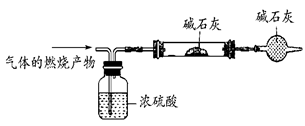
要达到实验的目的,需要下列哪些数据________(填编号)。
①此气体的质量 ②浓硫酸的增重 ③硬质玻璃管的增重
④干燥管的增重 ⑤此气体的体积(标准状况下)
(4)将这种气体在高温高压条件下与苯甲醛按一定比例混合,结果发现苯甲醛的质量和性质都没有发生变化,且还得到了一种白色固体。试推测苯甲醛的作用是________。得到的白色固体是________,发生的反应是___________(填反应类型)。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反
应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;应该测定的实验数据是____________________________。
(3)在使用铁与稀硫酸反应制氢气时,实验室里选择粗铁比纯铁效果更好,原因是:。
该小组同学设计了甲、乙两套实验装置,对甲酸与甲醇进行了酯化反应的研究:
(1)装置乙中长导管的作用是。
(2)甲酸和甲醇(CH318OH)进行酯化反应的化学方程式。
(3)甲装置还是乙装置好?,其原因是。
(4)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有、两种必备用品。
(5)某同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释:。
中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题: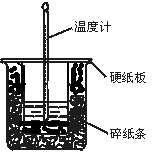
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(3)做一次完整的中和热实验,温度计需要使用______ 次;
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C =" 4.18" J/(g·℃),反应后温度升高了△t, 则生成1mol水时的反应热ΔH="___________" kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),简述理由。