某结晶水合物的化学式为R·nH2O,其相对分子质量为M, 25 ℃时,a g该晶体能够溶于b g水中形成V mL溶液。下列关系中不正确的是( )
A.该溶液中溶质的质量分数为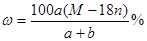 |
B.该溶液的物质的量浓度为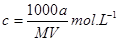 |
C.该溶液的密度为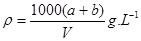 |
D.该溶液中溶质与溶剂的质量比为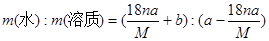 |
下列推论正确的
| A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3 |
| B.NH4+为正四面体结构,可推测出PH4+也为正四面体结构 |
| C.Si晶体是原子晶体,可推测由C所形成的晶体也是原子晶体 |
| D.NaCl是离子化合物,可推测AlCl3也是离子化合物 |
甲、乙两种非金属,能说明甲比乙的非金属性强的是
①甲比乙容易与H2化合 ②甲单质能与乙阴离子发生置换反应 ③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强 ④与某金属反应时,甲原子得电子数目比乙的多 ⑤甲的单质熔、沸点比乙的低 ⑥甲元素的气态氢化物的水溶液酸性比乙元素的气态氢化物的水溶液酸性强
| A.①②③⑥ | B.②③④ | C.①②③ | D.①②③④ |
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
依据元素周期表及元素周期律,下列推断正确的是
| A.同主族元素从上到下,单质的熔点逐渐降低 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA元素从上到下,其氢化物的稳定性逐渐增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
下列化学用语表示正确的是
A.CO2分子的比例模型示意图: |
B.三氟化氮的电子式: |
| C.二氧化硅的分子式:SiO2 | D.含有10个中子的氧原子: |