在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2).
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式
(2)已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阴极的电极反应式 ;
(3)某课题组以上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其他少量不溶于稀酸的物质)为原料,设计如图1流程对资源进行回收,得到Ce(OH)4和硫酸铁铵.

①得到滤渣B时,需要将其表面杂质洗涤干净.洗涤的操作是 .
②反应(1)的离子方程式为 .
③操作I的名称是
④如图2,氧化还原滴定法测定制得的Ce(OH)4产品的纯度.

该产品中Ce(OH)4的质量分数为 (保留小数点后两位).若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度 (“偏高”、“偏低”或“无影响”).
(19分) 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化,高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是__ __,发生反应的离子方程式为________。加高锰酸钾溶液前,若pH较低,对除杂的影响是_________。
(2)反应③的反应类型为___________,过滤得到的滤渣中,除了过量的锌外还有__________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是_________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2.取干操后的滤饼11.2g,煅烧后可得到产品8.1 g.则x等于 _________。
(8分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。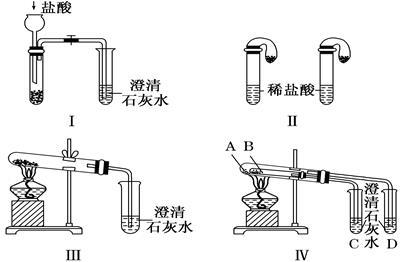
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:_________;
与实验Ⅲ相比,实验Ⅳ的优点是________(填选项序号)。
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是_______(填化学式)。
(1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/mol·L-1 |
V(Na2S2O3)/mL |
c(H2SO4)/mol·L-1 |
V(H2SO4)/mL |
V(H2O)/mL |
| ① |
25 |
0.1 |
5.0 |
0.1 |
10.0 |
a |
| ② |
25 |
0.1 |
10.0 |
0.1 |
10.0 |
0 |
| ③ |
25 |
0.2 |
5.0 |
0.1 |
5.0 |
b |
| ④ |
50 |
0.2 |
5.0 |
0.1 |
10.0 |
5.0 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验 (填实验编号);若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为 和 。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。
实验操作①中测试时pH试纸的颜色应该接近 。
A.红色B.黄色C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的 性。
(10)实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法。所用装置如下图。
请回答下列问题:
(1)仪器A和B的名称分别是 , 。
c(2)仪器B中水流方向如图中箭头所示,如此控制的原因是 。
(3)能证明乙醇分子中只有羟基上的氢才能生成H2的事实是
| A.乙醇完全燃烧生成水 |
| B.0.1 mol乙醇与足量金属钠反应生成0.05 molH2 |
| C.乙醇容易挥发 |
| D.乙醇能与水以任意比例互溶 |
(4)酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。在此过程中乙醇表现出了 (填“氧化性”或“还原性”)。在实验室里可以用铜作催化剂,进行乙醇的催化氧化,该反应的方程式为 。
(12分) 硝酸钾样品中含有少量碳酸钾、硫酸钾和难溶于水的杂质。提纯硝酸钾的实验时
先将硝酸钾样品溶于适量水中,充分搅拌后过滤,然后将滤液按下图所示步骤进行操作。
回答下列问题:
(1)你认为起始滤液中所含离子浓度最大的是 ,其理由是 。
(2)试剂I的化学式为 ,①中发生反应的离子方程式为 。
(3)②中加入试剂Ⅱ的目的是 ;试剂Ⅲ的名称是 ,
③中发生反应的离子方程式为____ 。
(4)由E溶液得到KNO3晶体需要____、____、过滤、洗涤、干燥、称量。若得到的晶体质量小于理论产量,其可能原因是 。
(5)为检验C固体的化学成分,A同学用盐酸溶解wg C固体,等完全反应后测得生成的CO2在标准状况下的气体体积为V mL。B同学将wg固体C灼烧至质量不再变化为止,冷却后称量剩余固体质量为bg。从化学定量实验的准确性原则来看,你认为 同学更加合理。