下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为_______________。
3CO2+4Al,则阳极的电极反应式为_______________。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________。(热回收效率= 回收能量/生产耗能x100%)
根据下图所示,推断物质X的化学式。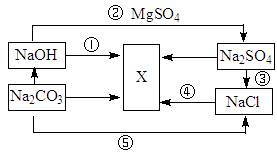
X的化学式
某混合物由NaCl、MgCl2两种物质组成,其中Na和Mg两种元素的质量比为23∶12。求
⑴NaCl与MgCl2的物质的量之比。
⑵氯离子总量为8mol时,Mg2+的物质的量是 。
。
8.4g N2与9.6g某单质Rx,所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是,x值为。
同温同压下,某瓶充满氧气时质量为116g,充满二氧化碳时,质量为122g,充满气体A时质量为114g,A的摩尔质量为________。
同温同压下,同体积的氨气(NH3)和硫化氢气体(H2S)的质量比为;同质量的氨气和硫化氢气体的体积比为其中含有的氢原子个数比为;若二者氢原子数相 等,它们的体积比为。
等,它们的体积比为。