在一个氧化还原反应中,氧化剂和还原剂转移的电子数应该相等。已知Na2SO3是一个具有还原性的盐。KMnO4是一个具有强氧化性的盐,易被还原为无色的Mn2+。两种物质均广泛用于工业合成上,回答下列问题。
(1)将Na2SO3溶液加入盛有下列溶液的试管中,试管内产生明显现象的是________
a.BaCl2溶液 b.淀粉碘化钾溶液 c.高锰酸钾溶液 d.NaOH溶液
(2)为了增强KMnO4溶液的酸性,实验室常在该溶液中加入一种酸,该酸是______
(3)KMnO4和亚铁离子在酸性条件下可得到Fe3+,且2Fe3++2I—=2Fe2++I2。在含1molKMnO4的溶液中加入2molFeI2固体,所得产物n(I2):n(Fe3+)为________
(4)工业合成中所用的Na2SO3固体中常含有Na2SO4和Na2CO3杂质,为测定固体中Na2SO3的含量,某兴趣小组设计以下三种方案,可行的一种是_______(填字母),利用该可行方案,所测的Na2SO3的质量分数为____________________。
a 方案:称量固体30g,溶于足量稀硝酸中,完全反应后,加入过量BaCl2溶液,充分反应后静置后,过滤、洗涤沉淀、干燥、称得沉淀质量为6.99g。
b 方案:称量固体30g,溶于足量稀盐酸中,产生的气体通入含0.1molKMnO4的酸性溶液,反应后再加入0.05mol的H2O2时,KMnO4的溶液恰好褪为无色。
c 方案:称量固体30g,溶于足量稀硫酸中,产生的气体全部被足量的澄清石灰水吸收,完全反应后,石灰水溶液增重6.4g。
(2014届北京市西城区高三4月一模考试理综化学试卷)
以铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝Alm(OH)nCl3m-n,生产的部分过程如下图所示(部分产物和操作已略去)。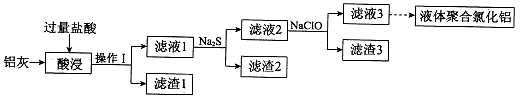
已知某些硫化物的性质如下表:
(1)操作I是 。Al2O3与盐酸反应的离子方程式是 。
(2)滤渣2为黑色,该黑色物质的化学式是 。
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7。NaClO的作用是 。
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝。反应的化学方程式是 。
(5)将滤液3电解也可以得到液体聚合氯化铝。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)。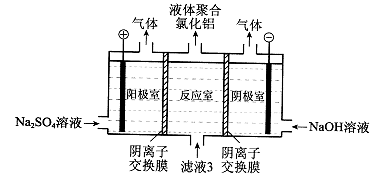
①写出阴极室的电极反应: 。
②简述在反应室中生成聚合氯他铝的原理: 。
(2014届江苏省高三百校联合调研测试(一)化学试卷)
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: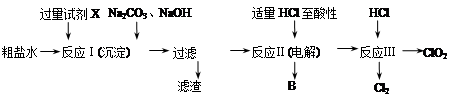
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
石油和煤炭加工过程涉及多种技术和设备。
(1)石油分馏时,在不断向______(填工业设备名称)内投放原料的同时获得产品,该过程为_______操作过程。
(2)石油裂化分为热裂化、_______和加氢裂化,裂化的目的是提高_______的产量。
(3)煤的洗选是为了降低原煤中灰分和______的含量。没得流化床燃烧是指空气从底部吹向煤炭颗粒,并使全部煤炭颗粒_______进行燃烧的过程。
(4)煤的直接液化是煤与适当溶剂混合后在高温和_______存在下与_______作用产生液体燃料的过程。
(2014届辽宁省东北三省高三第二次模拟考试理综化学试卷)
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。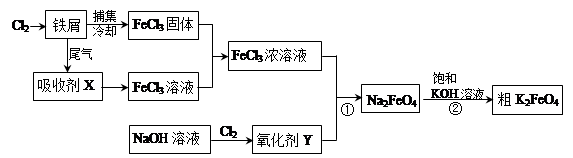
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O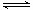 4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
| A.H2O | B.稀KOH溶液、异丙醇 | C.NH4Cl溶液、异丙醇 | D.Fe(NO3)3溶液、异丙醇 |
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
(2014届辽宁省东北三省高三第二次模拟考试理综化学试卷)
下图是某企业设计的硫酸—磷肥—水泥联产、海水—淡水多用、盐—热—电联产的三大生态产业链流程图。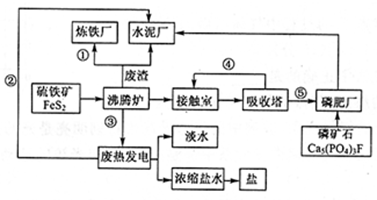
根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:① 、② 、③ 、④ 、⑤ 。
(2)沸腾炉发生反应的化学方程式: 。磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙得化学方程式 。
(3)用1吨硫铁矿(FeS2的质量分数为36%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸 吨。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。
, (写出两点即可)。