下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物。B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
请回答下列问题:
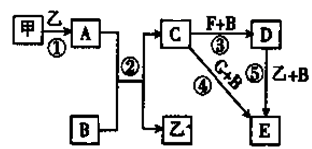
(1)A是 ,G是
(2)反应①~⑤中,属于氧化还原反应的是 (填序号)。
(3)反应⑤的化学方程式为 ;甲与B反应的离子方程式为 。
⑷在空气中将C溶液滴入F溶液中,观察到的现象是 。
(14分,每空2分)下列关系图中,A是一种正盐,E是强酸,当甲无论是强酸或强碱都有如下反应关系: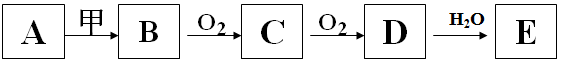
友情提示:当甲无论是强酸或强碱,A、B、C、D、E均为同种元素对应的不同的化合物。
回答下列问题:
(1)A是 (用化学式表示)
(2)当甲是稀盐酸溶液时,B为具有臭鸡蛋气味的气体
①写出B与C的反应方程式:
②一定质量的Zn与100mL 12.0mol/L的E的浓溶液充分反应,反应后称量剩余锌发现质量减少了65.0g。将反应后的溶液稀释至1L,此时溶液中c(SO42-)= mol/L,产生SO2体积(标准状况下)= L。
(3)当甲是浓氢氧化钠溶液时,B为易液化的气体可作制冷剂
①C是 ,在浓的E溶液中放入过量的铜片,则反应将要结束时的离子方程式为 。
②将盛有D和O2的混合气体12mL的量筒倒立于水槽中,充分反应后,剩余2mL无色气体(均在同温同压下测定),则原混合气体中氧气的体积是 。
A是一种军用催泪弹的主要成分,H可制得高聚物PLA。经分析A 的相对分子质量为161,除含有C、H外,它还含有一个卤原子,分子中只含有一个甲基。化合物A~H 的转化关系如下图所示,其中足量的新制Cu(OH)2 悬浊液与1 mol C 反应可生成1 mol Cu2O 和1 mol D,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1 和G2互为同分异构体,二者的核磁共振氢谱均只有两种氢环境,G1无甲基。
②一个碳原子上连有两个碳碳双键的结构(-C=C=C-)不稳定。
请完成下列问题:
(1)A 的结构简式: _ ;B1的分子式为 。
(2)反应④的化学方程式: 。
(3)写出H在一定条件下生成高聚物的反应方程式 。
(4)符合下列条件的E 的同分异构体共有 种。
①含有三个甲基;
②能与NaHCO3反应;
③-OH、-Br不连在同一个碳原子上。
(5)设计实验验C 中所含有的非氧官能团 ______ 。
科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学或医学奖。
请回答下列问题:
(1)已知M的分子量为227,由C、H、O、N周四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是____________________。D是双原子分子,分子量为30,则D的分子式为_______________。
(2)油脂A经下列途径可得到M。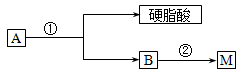
图中②的提示:
C2H5OH+HO-NO2 C2H5O-NO2+ H2O
C2H5O-NO2+ H2O
硝酸硝酸乙酯
反应②的化学方程式是 。
(3)C是B和乙酸在一定条件下反应生成的化合物,分子量为134,写出C所有可能的结构简式 。
化合物H可用以下路线合成: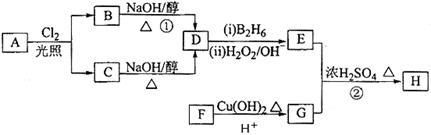
已知: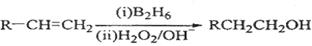
请回答下列问题:
(1)标准状况下11.2 L气态烃A在氧气中充分燃烧可以生成88 g CO2和45 g H2O,且A分子结构中有3个甲基,则A的结构简式为 ;
(2)B和C均为一氯代烃,D的名称(系统命名)为 ;
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3—苯基—1—丙醇。F的结构简式是 ;写出E与G反应生成H的结构简式是 。
(4)与G具有相同官能团的芳香类同分异构体有 种。
维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体合成路线如下:
已知:
回答下列问题:
(1)反应类型:① ④
(2)A和D的结构简式分别为: ;
(3)写出反应②的化学方程式:_________。实验中反应② 在K2CO3弱碱性条件下进行的原因是:____________。
(4)同样具有三个支链,且支链结构与B完全相同,属于芳香族化合物的B的同分异构体一共有 种(不包括B)
(5)反应⑥中(Boc)2O是由两分子羧酸C5H10O3脱水形成的酸酐,且(Boc)2O分子中氢原子化学环境只有1种,写出(Boc)2O的结构简式:
(6) 实验室还可用 和
和 直接反应生成E,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式________。
直接反应生成E,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式________。