常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
| A.<1.0×10-7mol/L |
| B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) |
| C.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-) |
| D.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-) |
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示。则下列选项正确的是
| A.原合金质量为0.92 g | B.标准状况下产生氢气896 mL |
| C.图中V2为60 mL | D.图中m值为1.56 g |
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是
| A.Zn和浓H2SO4 | B.Na2O2和NH4Cl浓溶液 |
| C.Cu和浓HNO3 | D.C和浓HNO3 |
常温下,下列各组离子在溶液中一定能大量共存的是
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl一、SO42一 |
| B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3一 |
C.pH=12的溶液: 、 、 、 、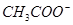 、Br- 、Br- |
D.由水电离产生的 的溶液: 的溶液: 、 、 、 、 、 、 |
将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81 g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀。由此可推断出X的化学式为
| A.K2SO4·2Cr2(SO4)3 |
| B.2K2SO4·Cr2(SO4)3 |
| C.K2SO4·1/2Cr2(SO4)3 |
| D.K2SO4·Cr2(SO4)3 |
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe Sb4O6+6FeS②Sb4O6+6C
Sb4O6+6FeS②Sb4O6+6C 4Sb+6CO↑,关于反应①、②的说法正确的是()
4Sb+6CO↑,关于反应①、②的说法正确的是()
A.反应①②中的氧化剂分别是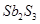 、 、 |
| B.反应②说明高温下C的还原性比Sb强 |
| C.反应①中每生成1mol FeS时,共转移3mol电子 |
| D.每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |