已知下表为25℃时某些弱酸的电离平衡常数;下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。
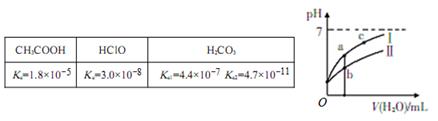
(1)图像中,曲线Ⅰ表示的酸是____(填化学式);
(2)a、b、c三点中,水的电离程度由大到小的顺序是___________(用编号表示)。
(3)25℃时,NaClO溶液的水解平衡常数Kh=_______________。
(4)25℃时,NaHCO3溶液存在水解平衡,写出其水解的离子方程式
(5)0.1mol/L Na2CO3溶液中c(OH-)—c(H+)=_________(用含c(HCO3-)、c(H2CO3)的关系式表示)。
A、B、C、D是四种有机物,它们的分子中含有两个碳原子,其中A和B是烃。在标准状况下,A对氢气的相对密度是13,B与HCl反应生成C,C与D混合后加入NaOH并加热,可生成B。
(1)写出A、B、C、D的结构简式。A、B、C、D、
(2)写出有关化学方程式:、
。
甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的棒;乙池中的棒。
②在乙池中阳极的电极反应式是。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复)。
| 阳离子 |
H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 |
OH-、Cl-、HCO3-、NO3-、SO42- |
已知:①0.1 mol/L A溶液的pH <1;②将B溶液分别与其它四种溶液混合,均有白色沉淀生成;
③C溶液 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题:
(1)写出下列物质的化学式:A______________、B______________。
(2)写出“C溶液 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。
(3)D、E两种物质中必有一种是_______________,写出将少量该物质的溶液滴加到B溶液中反应的离子方程式___________________________________________________________________。
(4)请你设计实验确定C及另一种未知物各是什么物质。(只许在A~E中选择检验试剂)
| 实验步骤 |
预期现象和结论 |
| 取适量C的溶液于试管中,① 。 |
预期现象和结论1:②; 预期现象和结论2:③; |
有A、B、C、D、E、F六种物质,它们之间相互转化关系如图所示(条件及部分产物未标出)。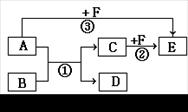
(1)若A、D为气体,都能使澄清的石灰水变浑浊;B、F做焰色反应,透过蓝色钴玻璃观察为紫色, B、C为正盐,F的溶液为紫红色。则C和F在酸性溶液中发生反应②的离子方程式为。
(2)若1 mol A分子中含有3 mol极性共价键, B、C、F都是短周期元素组成的非金属单质;常温下,只有D为固体,其它为气体。则反应③的化学方程式为。
某同学设计了如图所示装置(夹持仪器省略)进行上述(2)中物质B的化学性质探究。
①你认为此装置设计是否合理?若不合理如何改进:。(若合理此问不答)
②Ⅱ中产生的现象是。
③反应几分钟后,检验Ⅲ中可能含有的金属阳离子的实验操作是。
④通过以上探究,气体B的主要化学性质是。
近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前。“毒大米”是由镉污染引起的,会对人体健康造成严重危害。镉元素在元素周期表中的图示如图所示。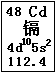
请回答下列问题:
(1)镉元素的原子序数为,在元素周期表中的位置是。
(2)有人说:“‘毒大米’中镉的含量很低,每人每天食用大米量也较少,所以,不会对人体健康造成严重危害。”你对这种说法有何评论?。
(3)你认为“毒大米”中镉的来源是什么?。
(4)镉也是生产电池的重要材料,镉镍二次电池(碱性)的放电和充电反应为:
Cd + 2NiO(OH) + 2H2O Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
电池的负极是。
负极的电极反应式为。
若负极消耗a g反应物,产生N个电子的电量,则阿伏加德罗常数NA=。