向某FeBr2溶液中,通入1.12 L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是
| A.原溶液的浓度为0.1 mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c (Br-)="0.4mol/L" |
元素的化学性质主要决定于()
| A.核外电子数 | B.原子结构 | C.核内中子数 | D.最外层电子数 |
2006年4月22日是第37个“世界地球日”,宣传主题是“善待地球——珍惜资源、持续发展”。下列活动或行为不符合这一主题的是()
| A.发展循环经济,构建资源节约型社会及清洁生产技术 |
| B.采用绿色化学生产工艺,提高原子利用率,建立环境友好型化工体系 |
| C.大量砍伐森林,以满足人们对木材的需求 |
| D.大力开发可再生资源,推广用乙醇汽油代替传统的燃油 |
以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入4.9g Cu(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体总体积为(标准状况):
| A.2.24L | B.1.12L | C.0.56L | D.3.36L |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):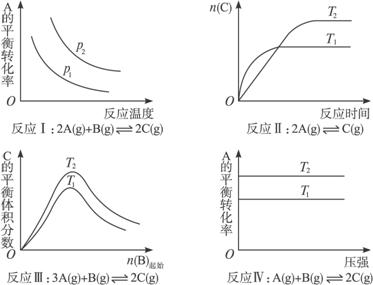
根据以上规律判断,下列结论正确的是( )
| A.反应Ⅰ:ΔH>0,p2>p1 |
| B.反应Ⅱ:ΔH<0,T1>T2 |
| C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1 |
| D.反应Ⅳ:ΔH<0,T2>T1 |
已知2SO2(g)+O2(g) 2SO3(g);△H= -197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2和1molSO3、1molSO2、0.5molO2,当它们分别达到平衡时放出的热量为Q1KJ和Q2KJ,则下列比较正确的是
2SO3(g);△H= -197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2和1molSO3、1molSO2、0.5molO2,当它们分别达到平衡时放出的热量为Q1KJ和Q2KJ,则下列比较正确的是
| A.Q2=1/2Q1=98.5 | B.Q2=1/2Q1<98.5 | C.Q2<1/2Q1<98.5 | D.无法确定 |