物质A是生产各种塑料的重要单体,工业上采用物质B分解制备物质A的同时释放出氢气,其制备原理是:B(g) A(g)+H2(g) ΔH=+125kJ·mol—1
A(g)+H2(g) ΔH=+125kJ·mol—1
(1)该反应的平衡常数表达式为K="______________。随着温度的升高,K" 值____________ (填“增大”、“减小”或“不变”)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。物质B的平衡转化率与水蒸气的用量、体系总压强关系如下图。
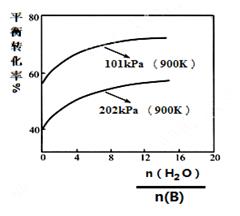
①由上图可得出:
结论一:
其他条件不变,水蒸气的用量越大,平衡转化率越___;
结论二 :______________________________________
②加人稀释剂能影响反应物B的平衡转化率的原因是:__________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高B的平衡转化率。试解释其原因:________________________。
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:

I.(1)请画出元素⑧的离子结构示意图。
(2)元素⑦中质子数和中子数相等的同位素符号是。
(3)④、⑤、⑦的原子半径由大到小的顺序为。(用半径符号表示)
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为>。
II.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答: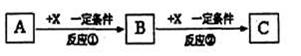
(1)若X是强氧性化单质,则A不可能是(填序号)。
a.S b.N2 c.C d.Al
(2)若A是饮食中的有机物,B与C分子量相差16则A与C反应的方程式:并指出反应类型
(3)若A,B、C为含有同一非金属元素的非电解质,写出符合上述关系A转化为B的化学方程式:
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2→O2。
(1)该物质H2O2在反应中表现出(填写编号)。
a、氧化性 b、还原性 c、氧化性和还原性 d、均不正确
(2)若反应转移了5.418×1023个电子,则产生的气体在标准状况下的体积是________L。
(3)将 氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目:
氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目: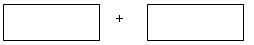
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O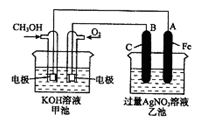
(1)请回答下列电极的名称:
通入CH3OH的电极名称是,
B(石墨)电极的名称是。
(2)写出电极反应式:
通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(3)乙池中反应的化学方程式为。
在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g) 3C(g) +
3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
(1)写出该反应平衡常数的表达式,
2分钟内B 的平均反应速度为
(2)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,
则正反应为(填“吸热”或“放热”)反应。
(3)若将容器体积缩小至1L,反应达到平衡时C的浓度为mol·L-1,
平衡常数(填“增大”、“减小”或“不变”)。
下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题: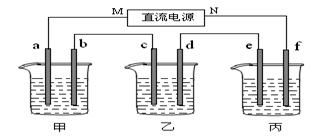
 (1)电源的N端为极;
(1)电源的N端为极;
(2)电极b上发生的电极反应为;
(3)电极c上生成的气体在标准状态下的体积:;
(4)甲溶液的氢氧根离子浓度为(设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为,e电极的材料是:,f电极的电极反应式为。