下列说法或表示方法中正确的是( )
| A.相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
| B.由C(石墨)→C(金刚石)ΔH=+1.9kJ/mol,可知金刚石比石墨稳定 |
| C.已知在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量。则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=+285.8kJ/mol |
| D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,若将含0.5mol硫酸的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ |
下列叙述中,正确的是:
A:某物质中只含有一种元素,该物质一定是纯净物。
B:某晶体中含有阳离子,则必定含有阴离子。
C:金属晶体的自由电子属整个晶体所共有。
D:金属晶体发生形变时其内部金属离子与自由电子的相互作用消失了。
将等物质的量的镁和铝相混合,取等质量的该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
| A.3 mol·L-1 HCl | B.4 mol·L-1 HNO3 |
| C.8 mol·L-1 NaOH | D.18 mol·L-1 H2SO4 |
CaC2和MgC2都是离子化合物,下列叙述正确的是
| A.MgC2和CaC2都能跟水反应生成乙炔 |
B.C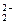 的电子式为[∶C┋┋C∶]2- 的电子式为[∶C┋┋C∶]2- |
C.CaC2在水中以Ca2+和C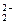 形式存在 形式存在 |
| D.MgC2的熔点低,可能在100 ℃以下 |
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红色粉末的质量仍为a g,则原合金中铁的质量分数为
| A.70% | B.52.4% | C.47.6% | D.30% |
把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子
| A.是Fe3+和Cu2+ | B.是Fe2+和Cu2+ |
| C.是Fe2+和Fe3+ | D.只有Fe2+ |