在一密闭容器中,反应aA(g) 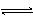 bB(g),达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,B的浓度是原平衡的60%,则( )
bB(g),达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,B的浓度是原平衡的60%,则( )
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.a > b |
下列说法正确的是
| A.红外光谱仪、质谱仪、核磁共振仪、紫外光谱仪和元素分析仪都是用于测定有机物结构的现代仪器 |
| B.工业上采用电解熔融氧化铝的方法冶炼铝,为了降低氧化铝的熔点,在实际生产中,向氧化铝中添加冰晶石 |
| C.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 |
| D.雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶 |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成下图所示的原电池。下列判断不正确的是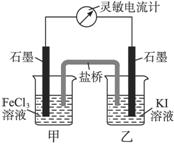

A.为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液 |
B.反应开始时,甲中石墨电极上Fe3+被还原,乙中石墨电极上发生氧化反应 |
C.电流计读数为零时,在甲中加入FeCl2固体后,甲中石墨电极为负极 |
| D.此反应正反应方向若为放热反应,电流计读数为零时,降低温度后,乙中石墨电极为负极 |
下列装置和操作能达到实验目的的是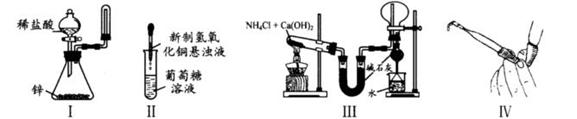
| A.实验I:制取并收集氢气 |
| B.实验II:验证葡萄糖的还原性 |
| C.实验III:实验室制氨气并收集干燥的氨气 |
| D.实验Ⅳ:检查碱式滴定管是否漏液 |
能大量共存于同一溶液中,且当改变条件使水电离的c(H+)=10-13mol/L时,一定能发生反应的离子组是
| A.S2-、Na+、SO32-、Cl- | B.Ca2+、NH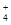 、SO 、SO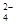 、SiO32- 、SiO32- |
C.Na+、Ba2+、Cl-、HSO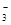 |
D.Al3+、Na+、SO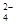 、NO 、NO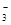 |
下列物质的转化在给定条件下能实现的是
①SiO2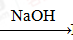 Na2SiO3
Na2SiO3 H2SiO3 ②Fe
H2SiO3 ②Fe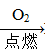 Fe2O3
Fe2O3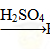 Fe2(SO4)3
Fe2(SO4)3
③BaSO4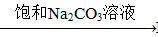 BaCO3
BaCO3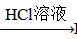 BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
④AlCl3溶液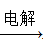 Al
Al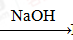 NaAlO2
NaAlO2
⑤HCHO HCOOH
HCOOH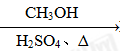 HCOOCH3
HCOOCH3
| A.①②⑤ | B.②③④ | C.②④⑤ | D.①③⑤ |