下列陈述Ⅰ、Ⅱ均正确且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
常温下铁与浓硫酸不反应 |
可用铁槽车密封运送浓硫酸 |
| B |
NaHCO3溶于水完全电离 |
NaHCO3是强电解质 |
| C |
NH4Cl为强酸弱碱盐 |
用加热法除去NaCl中的NH4Cl |
| D |
H2O2、SO2都能使酸性KMnO4溶液褪色 |
H2O2表现还原性、SO2表现漂白性 |
下列分离或提纯物质的方法正确的是
| 选项 |
物质 |
杂质 |
试剂及主要操作 |
| A |
苯 |
Br2 |
加苯酚过滤 |
| B |
CO2 |
HCl |
通过盛有饱和NaHCO3溶液的装置洗气 |
| C |
乙酸乙酯 |
乙酸、水 |
加饱和碳酸钠溶液分液 |
| D |
固体NH4Cl |
I2 |
加热 |
下列实验操作正确的是
| A.检验某溶液中是否含有乙醛:在盛有2 mL 10%硫酸铜溶液的试管中滴加10%氢氧化钠溶液0.5 mL,混合均匀,滴入待检液,加热 |
| B.实验室制硝基苯:先加入苯,再加浓硫酸,最后滴入浓硝酸 |
| C.配制少量银氨溶液:向盛有1毫升2%的硝酸银溶液中逐滴加入2%稀氨水边滴边震荡至最初产生的沉淀刚好消失为止 |
| D.提取在水中的碘:加入CCl4振荡、静置、分层后取出有机层,最后从分离出碘 |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是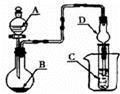
| A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 |
| C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后 沉淀又溶解 |
| D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
如图所示电化学装置,X可能为“锌棒”或“碳棒”,下列叙述错误的是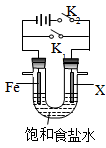
| A.X为锌棒,仅闭合K1,Fe电极上发生还原反应 |
| B.X为锌棒,仅闭合K1,产生微量电流方向:Fe→X |
| C.X为碳棒,仅闭合K2,该电化学保护法称为“牺牲阳极阴极保护法” |
| D.若X为碳棒,仅闭合K1,铁电极的极反应为:Fe -2e- → Fe2+ |
乙炔在不同条件下可以转化成许多化合物,如图,下列叙述错误的是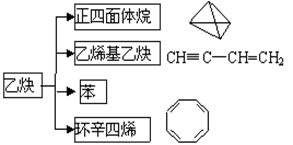
| A.正四面体烷的二氯代物只有1种 |
| B.乙炔生成乙烯基乙炔是加成反应 |
| C.等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不同 |
D.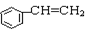 与环辛四烯互为同分异构体 与环辛四烯互为同分异构体 |