【化学—选修5:有机化学基础】
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
已知:(a)
(1)烃A的结构简式是___________;
(2)①的反应条件是___________;②的反应类型是___________;
(3)下列对抗结肠炎药物有效成分可能具有的物质推测正确的是_________;
| A.水溶性比苯酚好,密度比苯酚的大 |
| B.能发生消去反应 |
| C.能发生聚合反应 |
| D.既有酸性又有碱性 |
(4)E与足量NaOH溶液反应的化学方程式是_________;
(5)写出所有符合下列条件的E的同分异构体的结构简式_________;
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。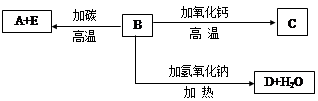
请填空:
(1)形成单质A的原子的结构示意图为,它的最高化合价为。
(2)B的化学式(分子式)为。B和碳反应生成A和E的化学方程式是。
(3)C的化学式(分子式)为,D晶体中化学键类型有。
(4)设计实验比较碳和A的非金属性强弱(用离子方程式表示)。
短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
| 乙 |
丙 |
丁 |
|
| 甲 |
戊 |
(1)甲在元素周期表中的位置是。
(2)原子半径:甲丁(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为,其中化学键的类型是(填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲丙(填“>”或“<”),下列事实能说明该结论的是。
A、丙的氢化物稳定,甲的氢化物不稳定
B、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C、丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)丙的单质的电子式为,乙与丁的原子构成的三原子分子的电子式为。
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)
请回答下列问题:
(1)A的电子式为。
(2)H的化学式为。
(3)写出反应①的离子方程式。
(4)写出反应②的化学方程式。
A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
| 物质组成 |
甲 |
乙 |
丙 |
丁 |
| 化合物中各元素 原子个数比 |
A和C 1:1 |
B和A 1:4 |
D和E 1:3 |
B和E 1:4 |
请回答下列问题:
⑴C的氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示):_____>_ __;
⑵元素E在周期表中的位置为第周期族;
⑶请写出两种与乙具有相同电子数的非单核离子的化学式:_____和_____;
⑷把D的单质放到NaOH溶液中,反应的化学方程式为:______________________;
⑸写出甲的电子式:________________;
⑹有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是: __ ___。
有机物A是最常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化: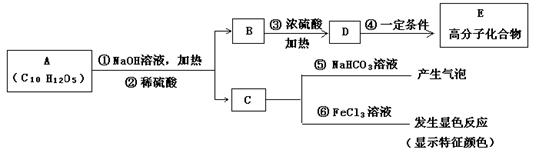




 已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为: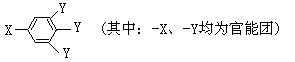
请回答下列问题:
(1)B的结构简式为C中含有的官能团-X的名称为
(2)反应④的反应类型为
(3)反应①的化学方程式为
(4)从分子结构上看,A作为食用油抗氧化剂的主要原因是
a.含有苯环 b.含有羰基 c.含有酚羟基