某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。

(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
| 滴定次数 |
待测液体积(mL) |
标准NaOH溶液读数记录(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
浓H2SO4和木炭在加热时发生反应的化学方程式是



 2 H2SO4 (浓) + C
2 H2SO4 (浓) + C  CO2↑+ 2 H2O + 2SO2↑
CO2↑+ 2 H2O + 2SO2↑ 请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻
璃管、胶管、铁夹、铁架台及加热装置等均略去)

 将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。

选用的仪器 (填字母) (填字母) |
加入的试剂 |
作用 |
    |
氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
 (1)某同学提出的假设是 ;
(1)某同学提出的假设是 ; (2)通过实验Ⅰ可以证明 ;
(2)通过实验Ⅰ可以证明 ; (3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入 ,再加入 。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入 ,再加入 。 (4)探究结果为 。
(4)探究结果为 。 (5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
(5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系 。





 (2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是(填装置的编号): → → →
(2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是(填装置的编号): → → → 。
。 (3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。 (4)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中的位置的理由是 。
(4)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中的位置的理由是 。 (5)装置③中所盛溶液是 ,可验证的产物是
(5)装置③中所盛溶液是 ,可验证的产物是 
根据下图所示实验回答下列问题:
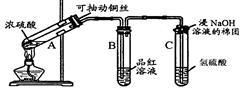
 (1)试管C口部的棉团上发生反应的离子方程式是 。
(1)试管C口部的棉团上发生反应的离子方程式是 。 (2)试管B中的实验现象是 ,若将该试管中反应后的溶液加热,可以观察到 。试管C中溶液变浑浊,则证明SO2具有 性。
(2)试管B中的实验现象是 ,若将该试管中反应后的溶液加热,可以观察到 。试管C中溶液变浑浊,则证明SO2具有 性。 (3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是 ,如果浸NaHCO3溶液,则发生反应的化学方程式是 。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是 ,如果浸NaHCO3溶液,则发生反应的化学方程式是 。
某学习小组对教材实验“在200mL烧杯中放人20 g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15 mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究。



 (1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。 同学们由上述现象推测出下列结论:
同学们由上述现象推测出下列结论: ①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性 其中依据不充分的是 (填序号);
其中依据不充分的是 (填序号); (2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
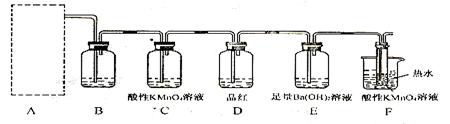
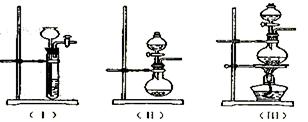
 试回答下列问题:
试回答下列问题: ①上图A中应选用下列装置 (填编号)。
①上图A中应选用下列装置 (填编号)。
 ②B装置所装试剂是 ;D装置中试剂的作用是
②B装置所装试剂是 ;D装置中试剂的作用是 ;E装置中发生的现象是 ;
;E装置中发生的现象是 ; ③A装置中使蔗糖变黑的化学反应方程式为 ;
③A装置中使蔗糖变黑的化学反应方程式为 ; ④F装置中酸性高锰酸钾溶液颜色变浅的原因是
④F装置中酸性高锰酸钾溶液颜色变浅的原因是 ;其反应的离子方程式是 。
;其反应的离子方程式是 。