下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
| A.Na2O和SiO2熔化 | B.碘和干冰升华 |
| C.氯化钠和蔗糖熔化 | D.Mg和S熔化 |
分析下列反应,在任何温度下均能自发进行的是
| A.2N2(g)+O2(g)===2N2O(g)ΔH=+163 kJ·mol-1 |
B.Ag(s)+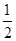 Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1 Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1 |
C.HgO(s)===Hg(l)+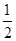 O2(g)ΔH=+91 kJ·mol-1 O2(g)ΔH=+91 kJ·mol-1 |
D.H2O2(l)=== 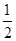 O2(g)+H2O(l)ΔH=-98 kJ·mol-1 O2(g)+H2O(l)ΔH=-98 kJ·mol-1 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.酒精可用作燃料,说明酒精燃烧是释放能量的反应 |
| C.干冰气化需要吸收大量的热,这个变化是吸热反应 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 |
在恒容的密闭容器中,可逆反应X(s)+3Y(g) 2Z(g);△H>0,达到平衡时,下列说法正确的是
2Z(g);△H>0,达到平衡时,下列说法正确的是
| A.充入少量He使容器内压强增大,平衡向正反应方向移动 |
| B.升高温度,平衡向正反应方向移动,平均分子量变小 |
| C.继续加入少量X,X的转化率减小,Y的转化率增大 |
| D.继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小 |
3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g) 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
| A.B的平均消耗速率为0.3mol/(L·min) |
| B.C的平衡浓度为2mol/L |
| C.平衡后,增大压强,平衡将向正方向移动 |
| D.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡 |
下列现象或反应的原理解释正确的是
| 现象或反应 |
原理解释 |
|
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |