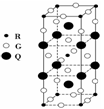
右图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为( )
| A.-2 | B. +2 | C.+3 | D.-3 |
将铁屑溶于过量的盐酸后再加入下列物质,会有三价铁生成的是 ( )
| A.硫酸 | B.盐酸 | C.硝酸锌 | D.氯化铜 |
位于规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的红棕色烟雾的困扰。你估计这一空气污染物中可能含有( )
| A.FeO粉尘 | B.碳粉尘 |
| C.Fe2O3粉尘 | D.Al2O3粉尘 |
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合溶液中Al2(SO4)3与MgSO4的物质的量浓度之比为
| A.6∶1 | B.3∶1 | C.2∶1 | D.1∶2 |
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是 ( )
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
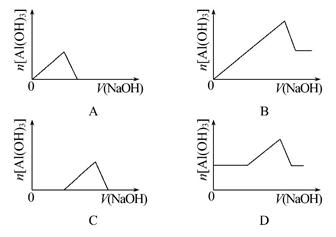
已知室温下,Al(OH)3的溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是 ( )