已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)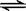 4H2(g)+2CO(g) ΔH=+255.6 kJ·mol-1
4H2(g)+2CO(g) ΔH=+255.6 kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)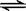 3H2(g)+2CO(g) ΔH=+13.8 kJ·mol-1,则下列说法不正确的是( )
3H2(g)+2CO(g) ΔH=+13.8 kJ·mol-1,则下列说法不正确的是( )
| A.降低温度,可提高b路线中乙醇的转化率 |
| B.从能源消耗的角度来看,b路线制氢更加有利 |
| C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源 |
| D.由a、b知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 |
活化分子是衡量化学反应速率快慢的重要依据,下列对活化分子说法中不正确的是( )
| A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 |
| C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快 |
| D.活化分子之间的碰撞一定是有效碰撞 |
化学平衡常数(K)是化学反应限度的一个重要参数,该常数表示的意义是可逆反应进行的程度,K值越大,表示的意义错误的是()
| A.温度越高 | B.反应物浓度越小 |
| C.反应进行的越完全 | D.生成物浓度越大 |
下列说法正确的是()
| A.凡是放热反应都是自发的,因为吸热反应都是非自发的 |
| B.熵增加的放热反应一定能自发进行 |
| C.自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
| D.自发反应在任何条件下都能实现 |
“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是其水溶液),盐酸必须避开它们,否则就无法通过。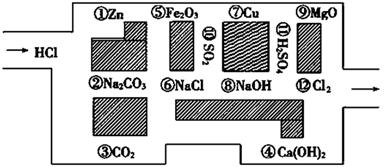
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________________。
(2)在不能与稀盐酸反应的物质中,属于电解质的是____________,属于非电解质的是____________。
(填写物质前的序号)
(3)能与稀盐酸发生氧化还原反应的是。
现有CuO、FeO、Fe2O3组成的混合物m g,向其中加入100mL 3mol·L-1硫酸,恰好完全溶解,若mg该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为
| A.(m-1.6)g | B.(m-2.4)g | C.(m-4.8)g | D.无法计算 |