下列离子方程式正确的是( )
| A.0.01mol/L NH4Al(SO4)2溶液与0.01mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
| C.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为: 4Fe2++6Br-+5Cl2= 4Fe3++3Br2+10Cl- |
| D.铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+= Fe3++3NO2↑+3H2O |
新教材中编有较多的“资料”“阅读”“选学”内容,根据有关内容判断下列说法不正确的是( )
| A.玻尔用王水保存了诺贝尔奖章 |
| B.门捷列夫编制的第一张元素周期表,是按照相对原子质量排列的 |
| C.人体血液的pH>7 |
| D.BaCO3俗称“钡餐” |
下列各组中的物质,互为同位素的是( )
| A.白磷与红磷 | B.苯与甲苯 |
| C.重氢与超重氢 | D.2-甲基丙烷与丁烷 |
下列表示式正确的是( )
A.氨分子的电子式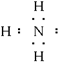 |
B.氢氧根离子的电子式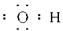 |
| C.乙酸的结构简式 C2H4O2 |
| D.苯的实验式 C6H6 |
在相同物质的量浓度的下列盐溶液中,c(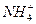 )最大的是()
)最大的是()
| A.NH4HSO4 | B.NH4HCO3 | C.CH3COONH | D.NH4Cl |
pH都为4的盐酸和NH4Cl溶液,向盐酸中加入amL水,向NH4Cl溶液中加入bmL水,结果两溶液的pH仍然相等。则a与b的关系正确的是()
| A.a<b | B.a>b |
| C.a="b" | D.无法确定 |