某一氯代烷1.85g,与足量的氢氧化钠溶液混合后加热,充分反应后,用足量硝酸酸化,向酸化后的溶液中加入20mL 1mol•L﹣1AgNO3溶液时,不再产生沉淀.
(1)通过计算确定该一氯代烷的分子式_____________________
(2)写出这种一氯代烷符合下列条件的结构简式:
①核磁共振氢谱有4组峰 ②水解产物经催化氧化生成醛类
下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
C |
N |
O |
|||||
| 3 |
Na |
Mg |
Si |
S |
Cl |
Ar |
||
| 4 |
Ca |
(1)金属性最强的元素是 (填元素名称);
(2)第三周期中,最高价氧化物水化物酸性最强的是 (填化学式);
(3)C和N中,原子半径较小的是 ;
(4)Si是带来人类文明的重要元素之一,其氧化物常用于制造 (填一种高性能的现代通讯材料的名称);
(5)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温 b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压 f.分离出甲醇
(3)右图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用____________的方法(填“升温”或“降温”)。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1③H2O(g)= H2O(l)ΔH=-c kJ·mol-1
写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式_________________。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/S |
X/mol |
Y/mol |
Z/mol |
 |
| 0 |
1.00 |
1.00 |
0.00 |
|
| 1 |
0.90 |
0.80 |
0.20 |
|
| 3 |
0.75 |
0.50 |
0.50 |
|
| 5 |
0.65 |
0.30 |
0.70 |
|
| 9 |
0.55 |
0.10 |
0.90 |
|
| 10 |
0.55 |
0.10 |
0.90 |
|
| 14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是______________
(3)列式计算该反应在0-3S时间内产物Z的平均反应速率:_______________
(4)该反应达到平衡时反应物X的转化率等于___________________________
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应的实验条件改变分别是:① _______ ②______ ③______。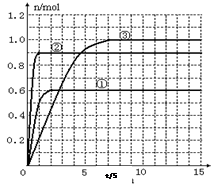
I.下列说法中正确的是_________。
A.制作航天服的聚脂纤维是新型无机非金属材料
B.肥皂可以用来去油污
C.金属的腐蚀属于物理变化
D.煤的气化属于化学变化
II.如图是找国科技工作者研制的以尿素为原料生产三聚氰胺(C3N6H6)的工艺——“常压气相一步法联产纯玻新技术”:
已知:①尿素的熔点是132.7℃ ,常压下超过160℃即可分解;②三聚氰胺的熔点是354℃,加热易升华,微溶于水。
请回答下列问题:
(1)以尿素为原料生产三聚氮胺的原理:____CO(NH2)2 ______C3N6H6+___NH3↑+__CO2↑
______C3N6H6+___NH3↑+__CO2↑
(配平化学方程式,在横线上填上相应物质的化学计量数),在实验室使尿素熔化的容器的名称为________。
(2)写出下列物质中主要成分的化学式:产品2_____、X_____ 。
(3)联氨系统沉淀池中发生反应的化学方程式为____________。
(4)为了使母液中析出更多的产品2,常用的方法是________。
A.加人NaOH固体 B.加入NaHCO3固体 C.通人CO2 D.通入NH3
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g) 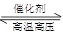 2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。